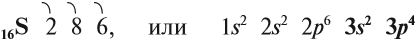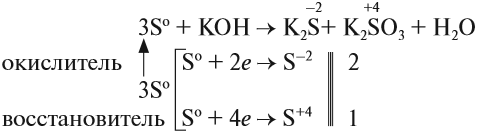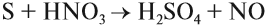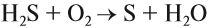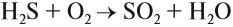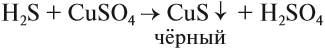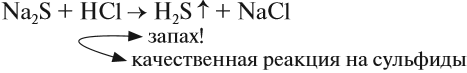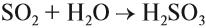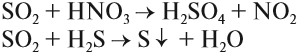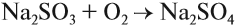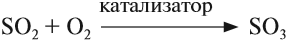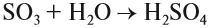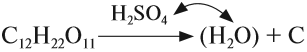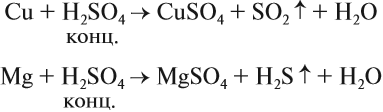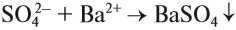Урок 15. Сера

Содержание
Строение атома и свойства серы
Сера — элемент шестой группы третьего периода периодической системы Менделеева. Поэтому строение атома серы изображается так:
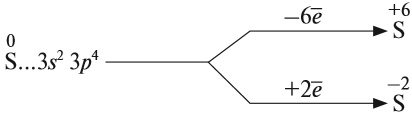
Строение атома серы указывает на то, что это неметалл, т. е. атом серы способен и к приёму электронов и к отдаче электронов:
Задание 15.1. Составить формулы соединений серы, содержащие атомы серы с данными степенями окисления.
Простое вещество «сера» — твёрдый хрупкий минерал жёлтого цвета, нерастворимый в воде. В природе встречается как самородная сера, так и её соединения: сульфиды, сульфаты. Сера как активный неметалл легко реагирует с водородом, кислородом, почти со всеми металлами и неметаллами:
Задание 15.2. Назовите полученные соединения. Определите, какие свойства (окислителя или восстановителя) проявляет сера в этих реакциях.
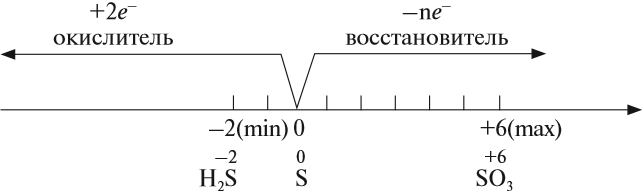
Как типичный неметалл простое вещество сера может быть и окислителем, и восстановителем:
Иногда эти свойства проявляются в одной реакции:
Поскольку атом-окислитель и атом-восстановитель одинаковые, их можно «сложить», т. е. на оба процесса нужно три атома серы.
Задание 15.3. Расставьте остальные коэффициенты в этом уравнении.
Сера может реагировать с кислотами — сильными окислителями:
Таким образом, являясь активным неметаллом, сера образует множество соединений. Рассмотрим свойства сероводорода, оксидов серы и их производных.

Сероводород
H2S — сероводород, сильно ядовитый газ с противным запахом тухлых яиц. Правильнее сказать, белки яиц при гниении разлагаются, выделяя сероводород.
Задание 15.4. Исходя из степени окисления атома серы в сероводороде, предcкажите, какие свойства будет проявлять этот атом в окислительно-восстановительных реакциях.
Поскольку сероводород — восстановитель (атом серы имеет низшую степень окисления), он легко окисляется. Кислород воздуха окисляет сероводород даже при комнатной температуре:
Сероводород горит:
Сероводород немного растворим в воде, причём его раствор проявляет свойства очень слабой кислоты (сероводородной H2S). Она образует соли сульфиды:
Вопрос. Как, имея сульфид, получить сероводород?
Сероводород в лабораториях получают, действуя на сульфиды более сильными (чем H2S) кислотами, например:

Сернистый газ и сернистая кислота
SO2 — сернистый газ с резким удушливым запахом. Ядовит. Растворяется в воде, образуя сернистую кислоту:
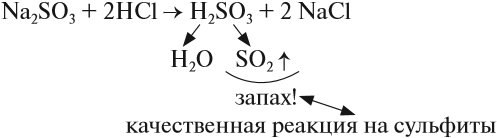
Эта кислота средней силы, но очень неустойчива, существует только в растворах. Поэтому при действии на её соли — сульфиты — другими кислотами можно получить сернистый газ:
При кипячении полученного раствора эта кислота разлагается полностью.
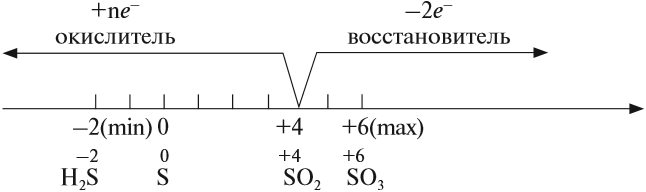
Задание 15.5. Определите степень окисления серы в сернистом газе, сернистой кислоте, сульфите натрия.
Поскольку степень окисления +4 для серы является промежуточной, все перечисленные соединения могут быть и окислителями и восстановителями:
Например:
Задание 15.6. Расставьте коэффициенты в этих схемах методом электронного баланса. Укажите, какие свойства проявляет атом серы со степенью окисления +4 в каждой из реакций.
Восстановительные свойства сернистого газа применяются на практике. Так, при восстановлении теряют цвет некоторые органические соединения, поэтому оксид серы IV и сульфиты применяют при отбеливании. Сульфит натрия, растворённый в воде, замедляет коррозию труб, так как легко поглощает кислород из воды, а именно кислород является «виновником» коррозии:
Окисляясь в присутствии катализатора, сернистый газ превращается в серный ангидрид SO3:

Серный ангидрид и серная кислота
Серный ангидрид SO3 — бесцветная жидкость, бурно реагирующая с водой:
Серная кислота H2SO4 — сильная кислота, которая в концентрированном виде активно поглощает влагу из воздуха (это свойство применяется при осушении различных газов) и из некоторых сложных веществ:
Кроме того, концентрированная серная кислота, являясь сильным окислителем, окисляет углерод:
Поэтому, попадая на кожу, концентрированная серная кислота вызывает тяжёлые ожоги, а попадая на ткани, бумагу и другие вещества, обугливает их.
Являясь окислителем (+6 — высшая степень окисления для серы!), концентрированная серная кислота реагирует почти со всеми металлами (кроме железа и благородных металлов) без выделения водорода:
Задание 15.7. Уравняйте эти схемы методом электронного баланса. Укажите, какой атом является окислителем в каждом случае.
Но разбавленная серная кислота и её соли — сульфаты — окислительных свойств (за счёт атома серы) практически не проявляют:
Задание 15.8. Определите, какой атом является окислителем в данной реакции.
Растворы серной кислоты проявляют все свойства сильных кислот.
Задание 15.9. Составьте уравнения реакций, отражающие эти свойства. (При затруднении см. урок 2.2.)
Качественной реакцией на SO42– является образование белого осадка BaSO4, нерастворимого в кислотах:
Серная кислота имеет разнообразное применение: её используют при получении стиральных порошков, лекарств, красителей, удобрений и других необходимых веществ.

Выводы
Изложенное выше можно отразить в шутливом стишке: «Сера, сера, буква S, 32 атомный вес, сера в воздухе горит, образует ангидрид (какой кислоты?), ангидрид плюс вода — получилась кислота (какая?)».