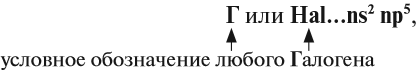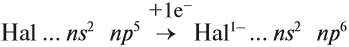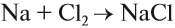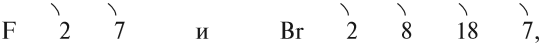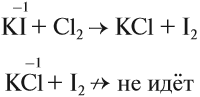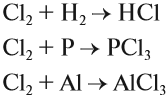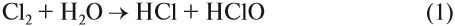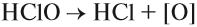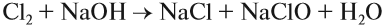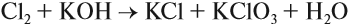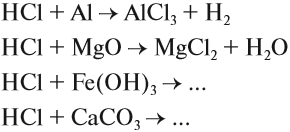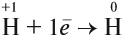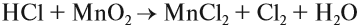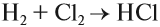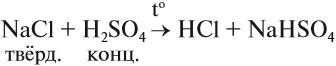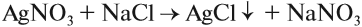Урок 16. Галогены

Строение атома и свойства галогенов
Галогены — общее название химических элементов, которые образуют главную подгруппу седьмой группы.
Задание 16.1. Назовите эти химические элементы.
Вопрос. Что общего в строении атомов этих элементов?
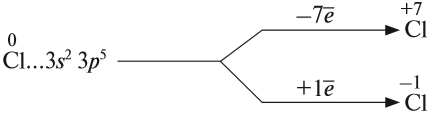
Атомы галогенов — F, Cl, Вr, I, At — имеют на внешнем уровне семь электронов:
где n — номер внешнего энергетического уровня (совпадает по величине с номером периода, в котором находится химический элемент), поэтому типичным процессом для всех галогенов в химических реакциях будет приём недостающих электронов до восьми (в данном случае одного электрона):
Таким образом, для этих атомов характерны свойства окислителей, и они легко реагируют с металлами (восстановителями), образуя соли:
Собственно, отсюда и возникло название «галоген»: «галос» — соль, «генес» — рождаю; галогены — образующие соли.
Вопрос. Чем различаются галогены по строению атомов?
Сравнив строение атомов любых двух галогенов:
легко видеть, что чем ниже в Периодической системе Менделеева находится данный галоген, тем дальше от ядра находятся его валентные электроны.
Вопрос. Влияет ли это на активность галогена как неметалла?
Поэтому сверху вниз (от фтора к астату) способность принимать электроны уменьшается, а значит, уменьшается окислительная и неметаллическая активность. В результате более активные галогены могут вытеснять менее активные галогены из их солей:
В таких реакциях атом галогена, входящий в состав соли, должен иметь низшую степень окисления –1.
Молекулы простых веществ-галогенов двухатомны. С увеличением их молярной массы увеличиваются температуры кипения и плавления этих веществ. Поэтому:
- F2 и Сl2 — газы;
- Br2 — бурая жидкость;
- I2 — тёмно-фиолетовые кристаллы, которые легко испаряются, если йод находится в открытой посуде.
Являясь сильными окислителями, все галогены сильно ядовиты. Но в виде соединений некоторые из них полезны. Например, простое вещество бром Br2 — ядовито, а соединения брома (бромиды) успокаивают. Именно их выписывают врачи, чтобы успокоить человека, уменьшить приступ кашля.
Рассмотрим некоторые свойства галогенов на примере хлора.
Задание 16.2. Изобразите строение атома хлора, определите его высшую и низшую степени окисления.
Все галогены, кроме фтора, могут проявлять в соединениях и отрицательные, и положительные степени окисления:
Задание 16.3. Составьте формулы соединений хлора, в которых атом хлора имеет эти степени окисления.
Простое вещество хлор — газ жёлто-зелёного цвета. Очень ядовит. Как и у других галогенов, молекула хлора двухатомна: Cl2. Являясь типичным и очень активным неметаллом, хлор может и принимать, и отдавать электроны, т. е. быть и окислителем, и восстановителем. Но окислительные свойства преобладают. Хлор реагирует с различными металлами и неметаллами:
а также с водой:
Задание 16.4. Определите, какие свойства проявляют атомы хлора в этих окислительно-восстановительных реакциях.
Раствор хлора в воде — хлорная вода — содержит слабую хлорноватистую кислоту НClO, которая довольно быстро разлагается, образуя атомарный кислород:
Хлорноватистая кислота и атомарный кислород — сильнейшие окислители, они разрушают красители, убивают микроорганизмы. Поэтому раствор хлора в воде используют для отбеливания тканей; при помощи хлора дезинфицируют воду.
Аналогичные процессы происходят при пропускании хлора в раствор щёлочи:
Обратите внимание. Щёлочь как бы нейтрализует те кислоты, которые получались в водном растворе в ходе реакции (1).
Если эта же реакция идёт при нагревании, то состав продуктов реакции изменяется:
Полученная соль — хлорат калия (Бертолетова соль) — является сильным окислителем. Так, она окисляет фосфор даже при слабом трении:
Эта реакция происходит всякий раз, когда вы чиркаете спичкой (в состав спичечной «головки» входит Бертолетова соль) о спичечный коробок (в его намазку входит фосфор).
Задание 16.5. Расставьте коэффициенты в последних двух уравнениях реакций методом электронного баланса. (В случае затруднений см. урок 7.)
Бертолетова соль входит в состав пиротехнических составов, например бенгальских огней.

Соляная кислота
Водородное соединение хлора — хлороводород — газ с резким запахом, хорошо растворимый в воде. Газ «хлороводород» не проявляет свойств кислоты, например не реагирует с металлами и твёрдыми щелочами. Раствор хлороводорода в воде называется «соляная кислота» и проявляет все свойства сильной кислоты.
Задание 16.6. Составьте уравнения реакций, которые характерны для сильной кислоты.
Поэтому соляная кислота реагирует с металлами, основными оксидами, основаниями, солями слабых кислот, образуя соли хлориды:
Задание 16.7. Закончить эти уравнения реакций.
В реакции с металлами HCl проявляет свойства окислителя, поскольку в процессе окисления участвует атом водорода в высшей степени окисления:
Вопрос. Какие свойства будет проявлять атом хлора, входящий в состав соляной кислоты в окислительно-восстановительных реакциях?
Соляная кислота HCl проявляет свойства восстановителя, если в реакции участвует атом хлора, так как этот атом находится в низшей степени окисления. Это свойство используется для получения хлора в лаборатории:
Сам хлороводород получается в больших количествах из газообразных простых веществ:
или в лабораторных условиях — действием концентрированной серной кислоты на сухую поваренную соль NaСl:
В данном случае при минимальном содержании влаги в смеси хлороводород выделяется в виде газа, и поэтому эта реакция возможна.
Задание 16.8. Составьте ионно-молекулярное уравнение аналогичной реакции, происходящей в растворе, и установите, возможна ли она.
В растворе реакция невозможна, поскольку все вещества — сильные и растворимые электролиты.
Качественной реакцией на хлорид-анион является взаимодействие растворов хлоридов, соляной кислоты с нитратом серебра:
Выпадает белый творожистый осадок AgCl.
Задание 16.9. Составьте краткое ионно-молекулярное уравнение этой реакции и убедитесь, что в ней участвуют ионы хлора.
Соляная кислота применяется для получения различных солей, для удаления накипи, оксидов и других отложений на различных поверхностях. Хлор и хлороводород широко применяются при синтезе органических соединений (см. следующий раздел).

Выводы
Галогены — сильные окислители, которые окисляют даже воду! Так, в струе фтора она горит синим пламенем. Все галогены реагируют не только с водой, но и с большинством металлов и неметаллов, кроме кислорода. Этот факт ещё раз подтверждает истину: похожие по свойствам вещества не реагируют: галоген (окислитель) + кислород (окислитель) → реакция не идёт. А с восстановителями реагируют очень интенсивно. Такими восстановителями являются органические вещества, свойства которых будут рассмотрены в следующем разделе.