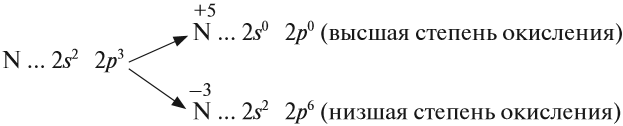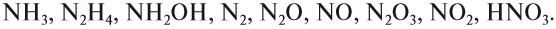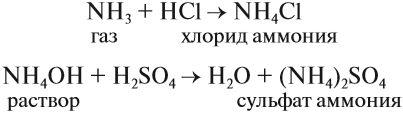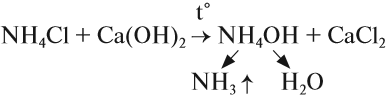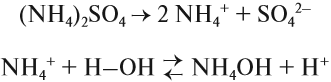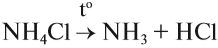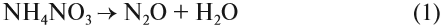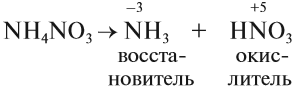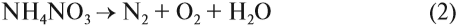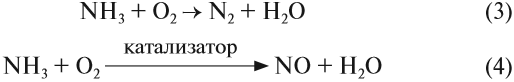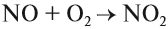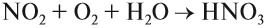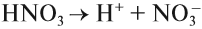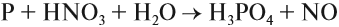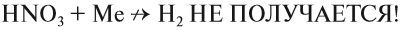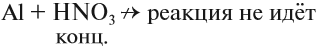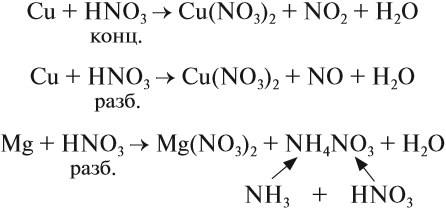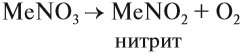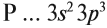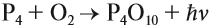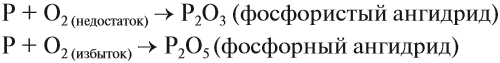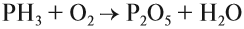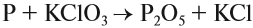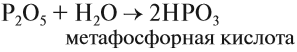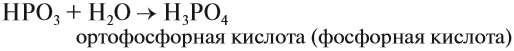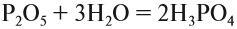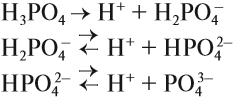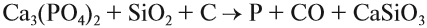Урок 14. Азот и фосфор

Содержание
Строение атома и свойства азота
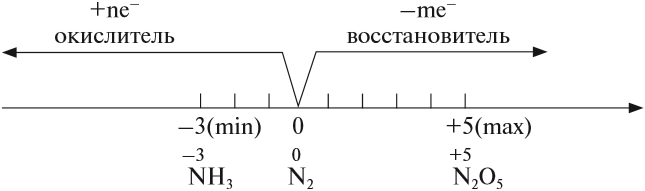
Азот — элемент пятой группы второго периода Периодической системы Менделеева.
Задание 14.1. Опишите строение атома этого элемента.
Имея на внешнем энергетическом уровне пять электронов, азот является типичным неметаллом, т. е. способен и принимать и отдавать электроны:
Задание 14.2. Составьте формулы простейших соединений азота с высшей (+5) и низшей (–3) степенями окисления (в случае затруднений см. урок 3).
Задание 14.3. Определите степени окисления азота в соединениях:
В своих соединениях атом азота может проявлять любые степени окисления от –3 до +5. Свойства некоторых из этих соединений будут рассмотрены ниже.
Простое вещество — азот N2 — составляет 4/5 Земной атмосферы. Азот в виде соединений (белков) входит в состав всех живых существ. Неорганических соединений азота в земной коре очень мало: 0,002 % по массе.
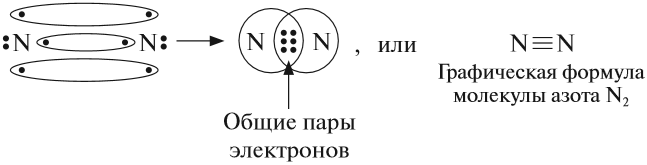
Вопрос. Какой тип химической связи соединяет атомы азота в его молекуле N2?
Поскольку в этой молекуле объединяются одинаковые атомы — связь ковалентная неполярная:
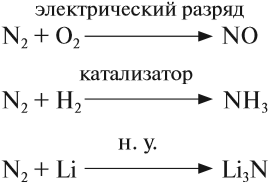
Кроме того, это — тройная связь, на разрыв которой требуется затратить очень много энергии. Поэтому при нормальных условиях азот не реагирует ни с одним веществом, кроме лития. При определённых условиях (нагревание, присутствие катализатора) азот реагирует с некоторыми металлами и неметаллами:
Задание 14.4. Расставьте коэффициенты. Определите, какие свойства (окислителя или восстановителя) проявляет азот в этих реакциях.
Поскольку атом азота в молекуле азота N2 имеет промежуточную степень окисления 0, в химических реакциях он может быть и окислителем и восстановителем:
Так как азот с трудом вступает в химические реакции, он относится к инертным газам и используется там, где нужно изолировать что-либо от окислительного действия кислорода: внутри баллона лампочки накаливания, атмосфера нефтехранилища и т. д.
Очень низкая температура кипения жидкого азота (–195,8 °C) позволяет быстро замораживать пищевые продукты и сохранять их в таком виде длительное время.
Важнейшими органическими соединениями азота являются белки, которые входят в состав любого живого организма. Но большинство живых существ не могут получать белки из атмосферного азота (связывать азот). Для этого нужны его соединения. Важнейшими неорганическими соединениями азота являются аммиак, азотная кислота и их соли.

Аммиак и соли аммония
Аммиак NH3 — бесцветный газ с резким запахом, ядовит.
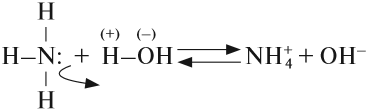
Задание 14.5. Составьте электронную и графическую формулы аммиака и определите тип химической связи в этой молекуле.
Поскольку связь N-Н сильно полярна, аммиак очень хорошо растворяется в полярном растворителе (воде) и реагирует с нею:
Вопрос. Какую реакцию среды имеет полученный раствор?
В результате этой реакции в растворе появляется избыток ионов ОН–, поэтому раствор аммиака в воде (аммиачная вода, нашатырный спирт) имеет щелочную среду и проявляет свойства слабого основания. Называется это основание «гидроксид аммония», и ему приписывают формулу NH4OH. Поскольку это щёлочь (растворимое основание), получаемая из летучего вещества (газа), её называют «летучей щёлочью».
Вопрос. Будет ли аммиак, а также его водный раствор реагировать с кислотами? щелочами?
Проявляя основные свойства, аммиак реагирует только с кислотами и не реагирует со щелочами:
В результате таких реакций образуются соли аммония, в которых вместо катиона металла имеется одновалентный катион аммония NH4+. Соли аммония имеют ряд особенностей:
1. Соли аммония, как соли слабого основания, реагируют со щелочами:
Задание 14.6. Составьте уравнение этой реакции в ионномолекулярном виде. Не забудьте, что гидроксид аммония — слабое основание.
Если такая реакция идёт при нагревании, то получается аммиак в виде газа. Это лабораторный способ получения аммиака:
Кроме того, появляется характерный запах — качественный признак присутствия солей аммония в смеси. Эту реакцию используют для получения аммиака в лаборатории.
Вопрос. Будут ли соли аммония подвергаться гидролизу?
2. Соли аммония, как соли слабого основания, подвергаются гидролизу:
Вопрос. Какая реакция среды получается в результате данного процесса?
Задание 14.7. Составьте уравнение реакции гидролиза нитрата аммония. Какой цвет имеет лакмус в этом растворе?
3. Соли аммония, как соли летучего основания, разлагаются при нагревании. При этом может выделяться аммиак:
Но если соль образована кислотой, анион которой является сильным окислителем, аммиак не выделяется:
Почему в этом случае не выделяется аммиак? Возможно, что сначала процесс идёт как обычно:
Но поскольку азотная кислота — окислитель, а аммиак — восстановитель, они тут же реагируют друг с другом. При разложении нитрата аммония возможны и другие продукты реакции:
Задание 14.8. Составьте электронный баланс для реакций (1) и (2), укажите окислитель и восстановитель.
Вопрос. Почему атом азота в аммиаке проявляет восстановительные свойства? Может ли этот атом принимать электроны?
Атом азота в молекуле аммиака имеет низшую степень окисления –3 и поэтому способен только отдавать электроны и проявлять восстановительные свойства. Поэтому аммиак легко реагирует с окислителями, например с кислородом, и горит:
Реакция (3) практического смысла не имеет: зачем возвращать в атмосферу азот, который только что с таким трудом был превращён в аммиак? Зато реакция (4) каталитического окисления аммиака используется при получении азотной кислоты. Кроме того, аммиак и его соли применяются как азотные удобрения, а нитрат аммония входит в состав взрывчатых смесей.

Азотная кислота и её соли
Азотную кислоту получают в три стадии. Первая — каталитическое окисление аммиака. Полученный бесцветный газ NO окисляют в бурый газ NO2:
Эта реакция идёт даже при нормальных условиях. Полученный бурый газ NO2 очень ядовит, имеет резкий запах. Растворением его в воде в присутствии кислорода получают азотную кислоту:
Азотная кислота — очень сильный электролит, в растворе полностью диссоциирует на ионы:
Вопрос. Какие свойства проявляет атом азота азотной кислоты в окислительно-восстановительных реакциях?
Поскольку атом азота в азотной кислоте находится в высшей степени окисления +5, азотная кислота — сильный окислитель. Она окисляет и простые и сложные вещества:
Органические вещества, входящие в состав бумаги, хлопка, скипидара, могут загореться при соприкосновении с концентрированной азотной кислотой. Не удивительно поэтому, что при взаимодействии металлов с азотной кислотой не удаётся получить водород в качестве продукта реакции:
Действительно, водород — восстановитель, а азотная кислота — окислитель, и они легко реагируют друг с другом в момент выделения водорода. В результате таких реакций образуются оксиды азота или аммиак, который образует с азотной кислотой соль аммония:
Обратите внимание.
- Концентрированная азотная кислота не реагирует с алюминием, хромом и железом, так как образует на их поверхности прочную оксидную плёнку, которая предохраняет металл от дальнейшего окисления (пассивирует его).
- Азотная кислота реагирует даже с теми металлами, которые стоят в ряду напряжений после водорода (водород и здесь НЕ выделяется!).
- Продукт реакции зависит и от активности металла и от разбавления кислоты: чем активнее металл и чем разбавленнее кислота, тем сильнее восстанавливается кислота, т. е. сильнее изменяется степень окисления атома азота (вплоть до –3).
Задание 14.9. Расставьте коэффициенты в этих уравнениях реакций, пользуясь методом электронного баланса.
В любой из этих реакций образуется соль азотной кислоты — нитрат. Нитраты — это хорошо растворимые соли, применяемые часто в качестве удобрений (KNO3, NH4NO3). Соединения азота используются в качестве удобрений, поскольку растения, как и человек, не способны усваивать азот воздуха, т. е. не способны превращать N2 в органические соединения азота. А без этих соединений — аминокислот, белков, нуклеиновых кислот — жизнь в принципе невозможна.
При использовании таких удобрений следует помнить, что избыток нитратов в почве и растениях опасен для жизни, так как нитраты ядовиты!
Нитраты легко разлагаются при нагревании, причём продукты разложения зависят от активности металла. Так, нитраты очень активных металлов — селитры — разлагаются по схеме:
Задание 14.10. Составьте уравнение реакции разложения нитрата натрия.
Селитры входят в состав взрывчатых веществ. Так, нитрат калия входит в состав чёрного пороха. Действием на сухие нитраты концентрированной серной кислотой можно получить азотную кислоту.

Строение атома и свойства фосфора
Фосфор был получен и назван алхимиком Брандом*, который пытался найти философский камень.
* БРАНД Хённинг (ок. 1630–после 1710) — немецкий алхимик без специального образования, профессиональный военный.
Этот камень, по убеждению алхимиков, мог превращать металлы в золото, обладал магическими свойствами. В 1669 году Бранд из остатков прозаической мочи выделил вещество, которое светилось в темноте. Безусловно, такими свойствами мог обладать только философский камень! Увы, никакими чудодейственными свойствами это вещество не обладало, но способность свечения в темноте подарило веществу и химическому элементу имя: его назвали фосфор, что означает «несущий свет».
Задание 14.11. Составьте электронную схему строения атома фосфора, укажите распределение валентных электронов, возможные степени окисления.
Распределение валентных электронов атома фосфора:
Поэтому фосфор проявляет в соединениях степени окисления –3, +3 и +5.
Задание 14.12. Составьте формулы водородных соединений, оксидов и гидроксидов фосфора, которые соответствуют этим степеням окисления.
Ниже мы рассмотрим свойства этих соединений, но вначале следует описать свойства простого вещества.
Как и для углерода, для фосфора характерно несколько аллотропных модификаций. В природе они не встречаются ввиду высокой активности этого неметалла. Почему, собственно, светился фосфор, полученный алхимиком? Потому что это был белый фосфор. Он имеет состав Р4. Это неполярное вещество, легко испаряется (возгоняется), причём пары белого фосфора окисляются на воздухе. При этом энергия химической реакции переходит в световую:
Появляется свечение.
Полученный оксид проявляет ярко выраженный кислотные свойства, так как фосфор — активный неметалл, а степень окисления атома фосфора — высшая. Поэтому при попадании на кожу белого фосфора появляются глубокие, плохо заживающие ожоги. Кроме того, белый фосфор, его пары — токсичное вещество. Белый фосфор — желтоватое мягкое вещество, растворимое в неполярных растворителях.
В противоположность ему — красный фосфор достаточно инертное вещество, безвредное для человека, но при условии, что оно — абсолютно чистое. Примеси белого фосфора, которые довольно часто встречаются, делают его ядовитым. В чём причина такого разительного изменения свойств? В том, что красный фосфор и другие аллотропные модификации фосфора — являются неорганическими полимерами. И чем выше степень полимеризации, тем инертнее вещество, тем темнее цвет. В настоящее время кроме чёрного фосфора описаны свойства жёлтого, алого, фиолетового, коричневого и даже стеклообразного.
Чаще всего встречаются и используются белый, красный и чёрный фосфор. Рассмотрим свойства красного фосфора.
Красный фосфор — это красно-бурый аморфный порошок практически нерастворимый в воде и неполярных растворителях, поскольку это полимер. Степень полимеризации установить невозможно, поэтому химическая формула Р. В зависимости от того, происходит ли горение в избытке или недостатке кислорода, образуются разные оксиды:
Кроме того, фосфор реагирует с активными металлами и неметаллами:
Задание 14.13. Составить уравнение реакции фосфора с кальцием. Назвать полученное вещество.
Фосфиды, как и нитриды, силициды, разлагаются водой и кислотами. В результате образуется фосфин — ядовитый газ с неприятным чесночным запахом. Он способен самовоспламеняться на воздухе:
Именно огоньки-вспышки этого газа пугают прохожих на кладбищах, поскольку фосфин образуется при гниении белковых тел. А это означает, что фосфор, как и азот, — биогенный элемент. Биологические свойства соединений фосфора будут рассмотрены ниже.
Вышеперечисленные реакции подтверждают ранее установленное правило: атомы с промежуточной степенью окисления проявляют свойства и окислителя, и восстановителя. Восстановительные свойства фосфора проявляются при взаимодействии с бертолетовой солью KClO3:
Эта реакция начинается при лёгком нагревании, трении, а иногда и без причин. В результате может произойти сильная вспышка. Мы её наблюдаем всякий раз, как только чиркаем спичкой о спичечный коробок. В состав спичечной головки входит бертолетова соль KClO3 и сера, а в состав намазки — красный фосфор и толчёное стекло.
Свойства и значение соединений фосфора
Как уже было показано выше, фосфор образует два вида оксидов Р2О3 и Р2О5. Это кислотные оксиды, образующие с водой фосфористую кислоту Н3РО3 и несколько фосфорных кислот. Состав фосфорных кислот отражает формула х Р2О5 · у Н2О:
Метафосфорная кислота неустойчива и, присоединяя воду, превращается в более устойчивую кислоту:
Или в суммарном виде:
Ортофосфорная кислота диссоциирует в три стадии:
Поэтому она образует три вида солей: КН2РО4 — дигидрофосфат, К2НРО4 — гидрофосфат, К3РО4 — фосфат. Эти соли, их растворы имеют разные свойства. Так, если большинство фосфатов нерастворимы в воде, кислые фосфаты имеют бОльшую растворимость.
Поскольку фосфор химически активен, в природе встречаются только нерастворимые соединения фосфора, в основном фосфаты. Они составляют основу таких минералов как апатиты и фосфориты. Основу фосфоритов составляет фосфат кальция, а в состав апатитов кроме него входят хлориды и фториды кальция.
Аналогичный состав имеют наши кости (фосфориты) и зубы (фторапатиты). В теле взрослого человека до 1,5 кг этого химического элемента. Таким образом, фосфор — биогенный элемент. Атомы фосфора входят в состав ДНК и РНК (нуклеиновых кислот), которые хранят и воспроизводят генетическую информацию. Кроме того, атомы фосфора входят в состав АТФ (аденозинтрифосфорной кислоты), при гидролизе которой выделяется аккумулированная в этой молекуле энергия.
Фосфор в чистом виде получают при нагревании измельчённых фосфоритов с песком и коксом:
Полученный фосфор используется при изготовлении спичек и пиротехнических составов, ядохимикатов, СМС (синтетических моющих средств) и многого другого.

Выводы
Азот — это элемент жизни, поскольку он входит в состав любого живого организма в виде белков, нуклеиновых кислот. С другой стороны, газ азот обладает инертными свойствами, с трудом вступает в химические реакции, составляет основу атмосферы Земли. Фосфор совместно с азотом входит в состав ДНК, РНК, АТФ. Многочисленные соединения фосфора незаменимы в быту.