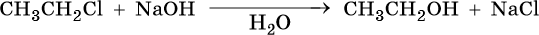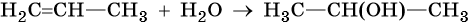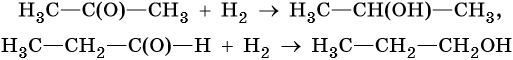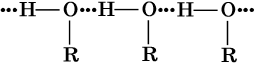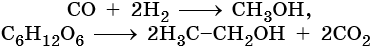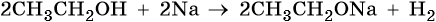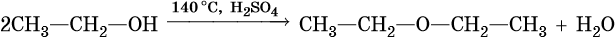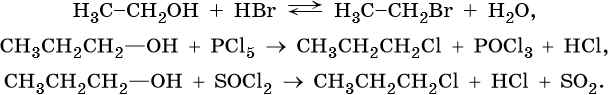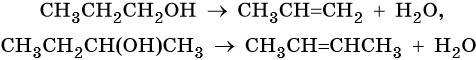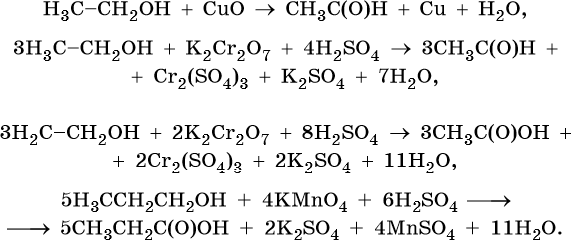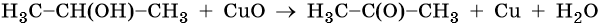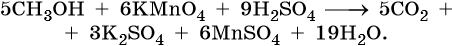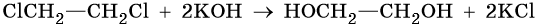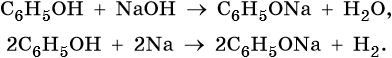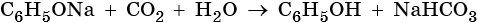Спирты и фенолы

Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильные группы (—OH).
По характеру радикала спирты классифицируют на насыщенные и ненасыщенные, по числу гидроксильных групп — на одноатомные, двухатомные, трехатомные и многоатомные.
В зависимости от того, к какому атому углерода присоединена гидроксильная группа, спирты делят на первичные, вторичные и третичные.
Для спиртов характерна изомерия углеродного скелета, изомерия положения гидроксильной группы, а также межклассовая изомерия с простыми эфирами.
Способы получения спиртов. Существует много способов получения предельных одноатомных спиртов.
1. Гидролиз моногалогенпроизводных алканов:
Эта реакция может протекать по различным механизмам в зависимости от строения исходного галоидного алкила и условий реакции.
2. Гидратация алкенов. Эта реакция идет в присутствии катализаторов, например серной или фосфорной кислоты, оксида алюминия. Направление реакции определяется правилом Марковникова:
3. Восстановление альдегидов и кетонов. В присутствии катализаторов альдегиды при восстановлении водородом переходят в первичные спирты, а кетоны — во вторичные:
В жидком состоянии молекулы спиртов ассоциированы за счет образования водородных связей:
Метиловый спирт получают из синтез-газа, а этиловый — при спиртовом брожении глюкозы:
Химические свойства спиртов определяются наличием реакционноспособной гидроксильной группы и строением связанного с ней углеводородного радикала. Ниже приведены некоторые характерные для спиртов реакции:
Ряд реакционной способности спиртов в реакциях со щелочными металлами: первичные > вторичные > третичные.
Образовавшиеся алкоголяты под действием воды разлагаются на спирт и соответствующую щелочь:
Образование простых эфиров:
Образование галоидных алкилов:
Внутримолекулярная дегидратация спиртов. Реакция идет в присутствии катализатора — серной кислоты (температура 170 °С) или в присутствии Al2O3 при температуре 400 °С. Отщепление атома водорода подчиняется правилу Зайцева: атом водорода отщепляется от наименее гидрогенизированного атома углерода. Примеры:
Реакции окисления. Спирты окисляются под действием сильных окислителей. Направление реакции зависит от природы окислителя и температуры реакции. Оксид меди при нагревании окисляет спирты до альдегидов. Бихромат калия или перманганат калия в кислой среде на холоде окисляет первичные спирты до альдегидов, а при нагревании — до карбоновых кислот:
Вторичные спирты окисляются до кетонов, третичные спирты при обычных условиях не окисляются:
Метиловый спирт окисляется до углекислого газа:
Алкандиолами, или гликолями, называют двухатомные спирты, которые отвечают общей формуле CnH2n(OH)2 и содержат в своем составе две гидроксильные группы, расположенные при различных углеродных атомах. Для двухатомных спиртов возможна изомерия углеродного скелета и изомерия положения гидроксильных групп. Родоначальником двухатомных спиртов является этиленгликоль HOCH2—CH2OH.
Диолы получают водным или щелочным гидролизом дигалоидалканов или контролируемым окислением алкенов перманганатом калия в водном растворе.
Этиленгликоль получают гидратацией окиси этилена. Его химические свойства:
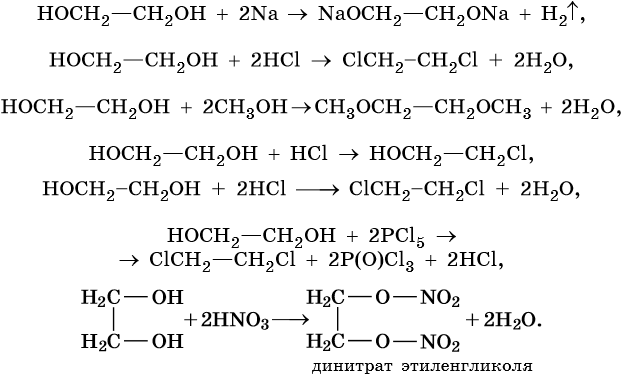
Качественная реакция для многоатомных спиртов — взаимодействие со свежеосажденным гидроксидом меди (II) с образованием комплексного соединения — гликолята меди, которое имеет характерную голубую окраску:
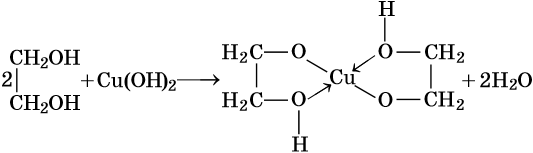
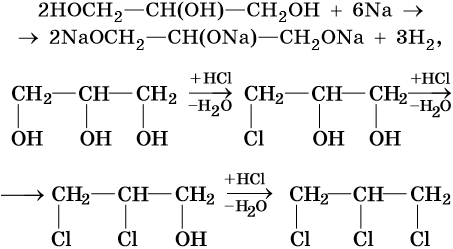
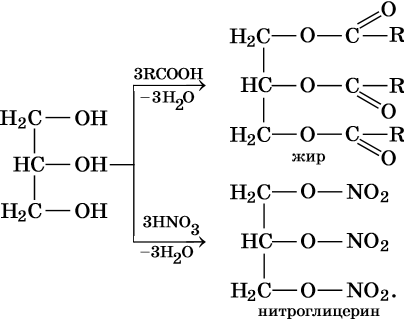
Трехатомные спирты, или триолы, отвечают формуле CnH2n–1(OH)3 и содержат в своем составе три гидроксильные группы, связанные с алифатическим углеводородным радикалом. Для трехатомных спиртов возможна изомерия углеродной цепи и изомерия положения гидроксильных групп. Их родоначальником является глицерин HOCH2—CH(OH)—CH2OH. Получают глицерин омылением растительных или животных жиров в присутствии щелочных или кислотных катализаторов. Его химические свойства:
Реакции этерификации:
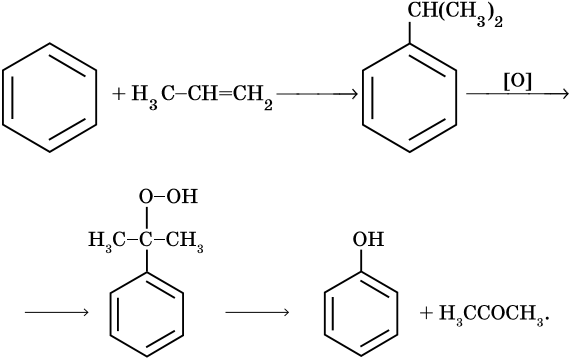
Фенолами называют соединения, у которых гидроксильная группа связана непосредственно с бензольным кольцом. По числу гидроксильных групп в кольце различают одно-, двух- и трехатомные фенолы. Для фенолов характерны изомерия относительного положения радикалов в кольце, структурная изомерия заместителей и межклассовая изомерия с ароматическими спиртами. Методы получения фенола и его гомологов. Фенол и его метильные гомологи — о-, м- и п-крезолы в значительном количестве встречаются в каменноугольной смоле. Фенол и ацетон получают в промышленности по методу Сергеева — Кружалова: бензол в присутствии безводного треххлористого алюминия реагирует с пропиленом с образованием изопропилбензола. При окислении этого соединения кислородом при температуре 110—130 °С образуется неустойчивое соединение — гидроперекись изопропилбензола. Под действием серной кислоты оно распадается на фенол и ацетон:
Химические свойства фенолов:
Разложение фенолятов:
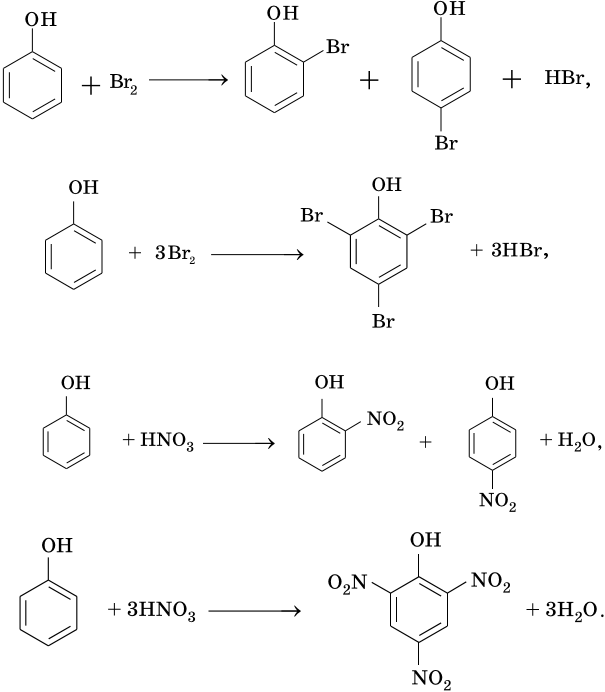
Реакции замещения (в зависимости от соотношения межд у реагентами образуются следующие продукты):
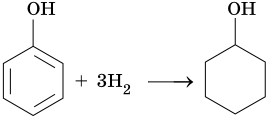
Гидрирование (на никелевых катализаторах):