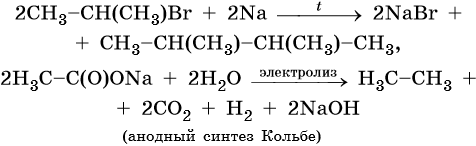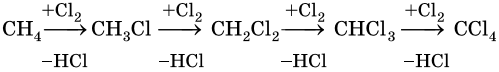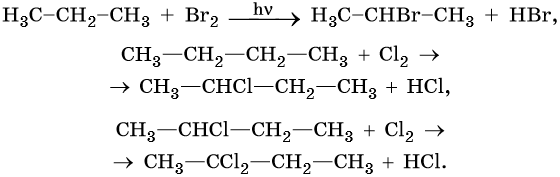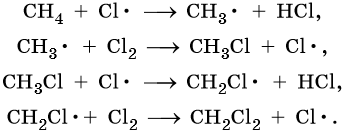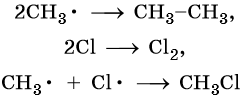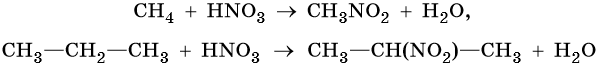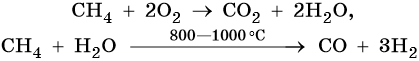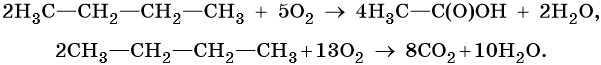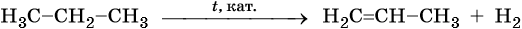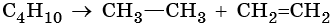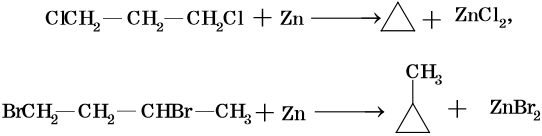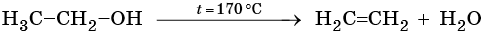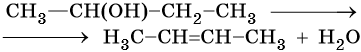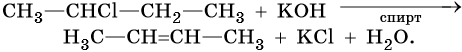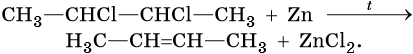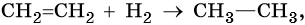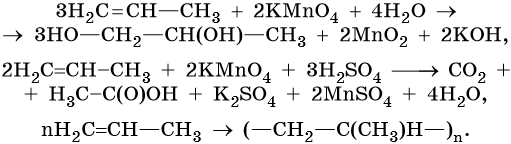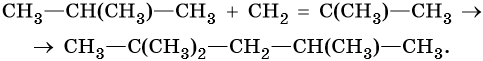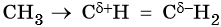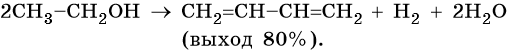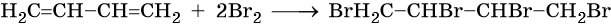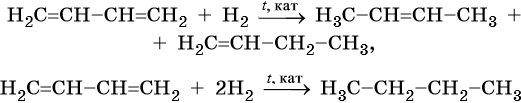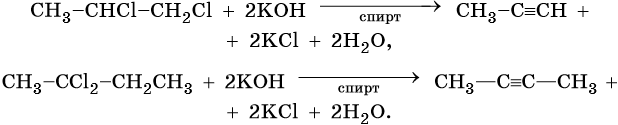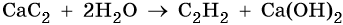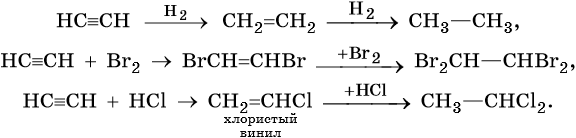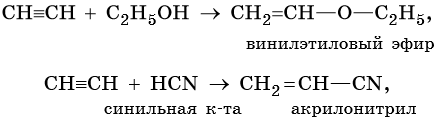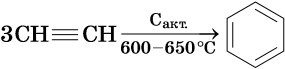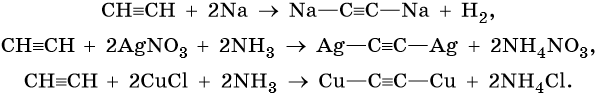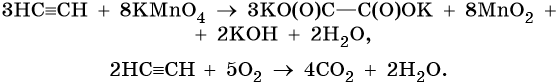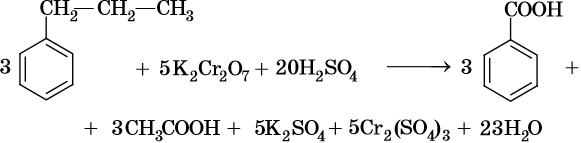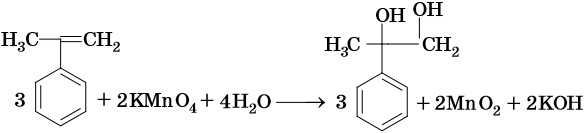Углеводороды

Углеводородами называют органические вещества, состоящие только из углерода и водорода. По составу их классифицируют на насыщенные и ненасыщенные, по строению — на алифатические, циклические и ароматические.
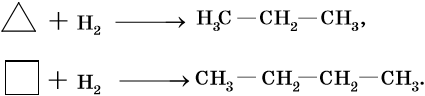
Алканами называют предельные алифатические углеводороды, отвечающие общей формуле CnH2n+2, в молекулах которых атомы углерода связаны между собой простой (одинарной) σ-связью.
Для алканов характерна изомерия углеродного скелета.
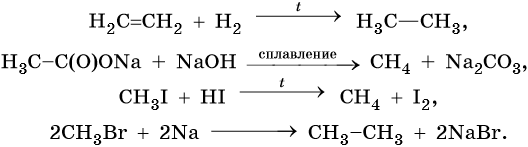
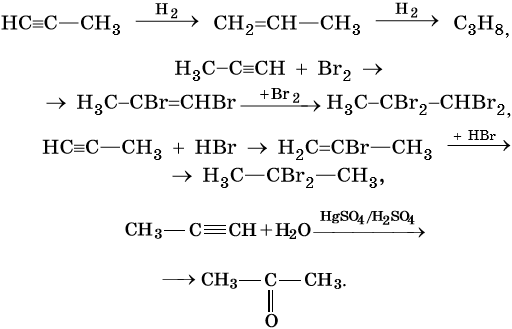
Способы получения алканов. Как правило, алканы получают из природного сырья, однако известно большое число синтетических методов их получения. Это реакции гидрирования алкенов и алкинов, декарбоксилирование натриевых или калиевых солей карбоновых кислот, восстановление йодалканов йодоводородом, реакция Вюрца:
Для алканов характерны реакции замещения, которые идут при нагревании или УФ-облучении. При этом происходит разрыв связи C—H с последующей заменой атома водорода на другой атом или группу атомов или же разрыв молекулы по связи C—С.
Большинство реакций алканов протекают по механизму радикального замещения SR. В этих реакциях реакционная способность атомов водорода убывает в ряду: третичные > вторичные > первичные.
Ниже приведены уравнения химических реакций, характерных для алканов.
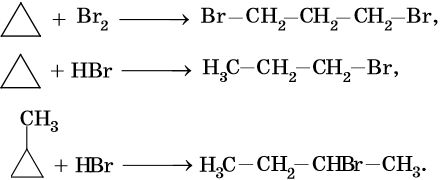
1. Галогенирование:
Реакция идет на свету или при температуре 250— 400 °С.
Реакционная способность галогенов в этой реакции уменьшается в ряду F2 > Cl2 > Br2 > I2.
Реакции замещения в алканах протекают по радикальному механизму. При этом легче всего происходит замещение атома водорода, связанного с третичным углеродным атомом, затем — со вторичным и наконец — с первичным. Это объясняют значением энергии связей C–H, имеющих величину для первичной около 419 кДж/моль, вторичной — 393,6 кДж/моль и третичной — 372,6 кДж/ моль.
Наиболее широко известны реакции галогенирования алканов. Эти реакции идут на свету или при нагревании в присутствии инициаторов радикальных реакций. Рассмотрим механизм реакции на примере хлорирования метана.
На первой стадии этой реакции происходит распад молекулы хлора на два свободных радикала:
Cl:Cl → 2Cl• — зарождение, или инициирование цепи. Затем начинается рост цепи, связанный с взаимодействием свободного радикала с молекулой метана, что приводит к образованию новых радикалов:
Реакция заканчивается обрывом цепи, который наступает в результате взаимодействия между собой свободных радикалов:
Механизм реакции галогенирования был установлен академиком Н.Н. Семеновым.
2. Нитрование:
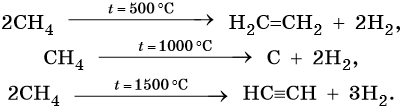
3. Термические превращения:
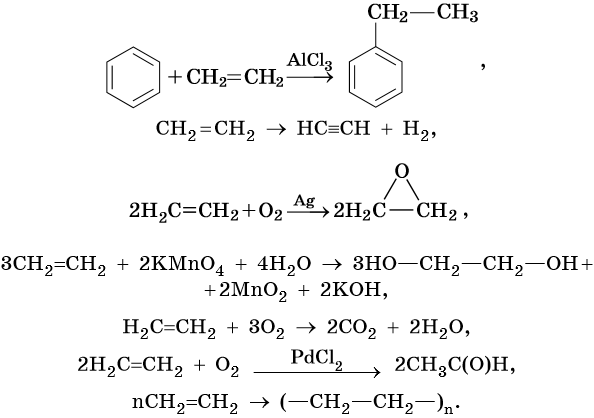
4. Окисление:
Каталитическое окисление бутана приводит к уксусной кислоте, а горение в кислороде — к углекислому газу и воде:
5. Дегидрирование:
Реакции дегидрирования (отщепления водорода) протекают по разным направлениям:
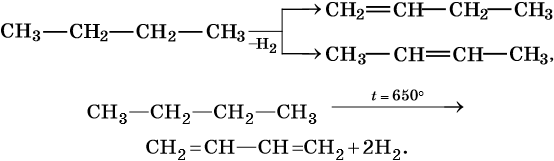
Изомеризация:
Крекинг:
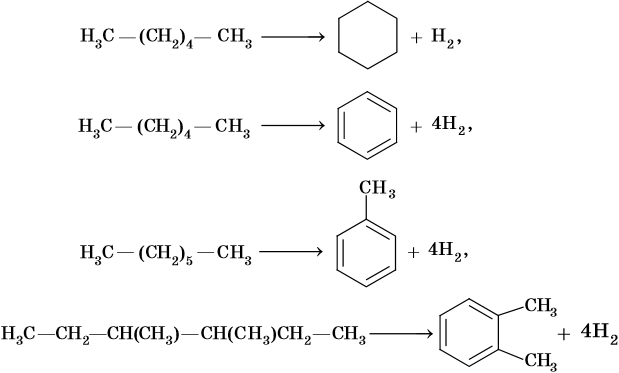
Реакции циклизации и ароматизации:
Последние две реакции идут при температурах 450–500 °С с использованием в качестве катализаторов оксидов хрома или алюминия.
Алициклическими называют углеводороды, которые содержат один или несколько циклов неароматического характера. По своим свойствам они схожи с соответствующими соединениями алифатического ряда. Термин «алициклические» означает «алифатические циклические» углеводороды. Несмотря на большое сходство между алифатическими и алициклическими соединениями, у последних имеются некоторые специфические свойства, обусловленные их циклической структурой. Общая формула гомологического ряда циклоалканов CnH2n.
Иногда циклоалканы называют нафтенами, т. к. производные циклопентана и циклогексана содержатся в некоторых сортах нефти.
Для гомологов и производных циклоалканов возможны следующие виды изомерии: изомерия, связанная с размером цикла, например, циклобутан является изомером метилциклопропана; изомерия положений заместителей в цикле; изомерия боковых цепей.
Циклопентан, циклогексан и их производные широко распространены в природе и составляют основную часть некоторых сортов нефти.
Низшие циклы синтезируют циклизацией дигалоидпроизводных, например:
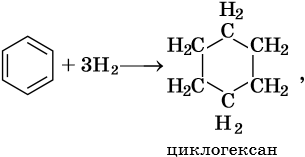
Циклобутан и циклопентан получают циклизацией 1,4-дибромбутана и 1,5-дибромпентана под действием амальгамы лития. Циклогексан и его производные получают из нефти или гидрированием бензола и его производных.
Химические свойства циклоалканов во многом определяются размерами цикла. Наибольшей химической стойкостью обладают пяти- и шестичленные циклы. Циклопропан склонен к многочисленным реакциям раскрытия цикла.
Гидрирование циклопропана и циклобутана идет над никелевым катализатором при температуре 80 и 120 °С соответственно. При этом образуются пропан и бутан.
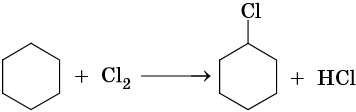
Циклопропановый цикл легко раскрывают при бромировании или гидробромировании, например:
В аналогичных условиях углеводороды от циклобутана до циклогексана вступают в реакции замещения:
Циклопропан используют в качестве анестезирующего средства. Циклогексан используют как растворитель. Окислением циклогексана получают циклогексанол C6H11OH, циклогексанон C6H10O и адиптиновую кислоту HOOC(CH2)4COOH. Циклогексанон является промежуточным продуктом при получении полиамидного волокна — капрона.
Алкенами, или олефинами, называют алифатические непредельные углеводороды, молекулы которых отвечают общей формуле CnH2n и имеют в своем составе одну двойную связь C=C. Родоначальником этого класса органических соединений является этилен CH2=CH2. Для алкенов характерна изомерия углеродного скелета, изомерия положения кратной связи, геометрическая изомерия, а также межклассовая изомерия с циклоалканами.
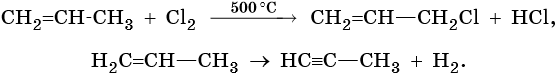
Способы получения алкенов. Этилен, пропилен и бутилены выделяют из газов нефтепереработки, образующихся при термическом крекинге. Алкены также образуются в большом количестве при пиролизе нефти.
Промышленным способом получения алкенов является дегидрирование алканов на катализаторе (K2O—Cr2O3—Al2O3), при температуре 560—620 °C из н-бутана образуются изомерные бутены. Еще легче этот процесс идет в случае изобутана:
Алкены получают дегидратацией спиртов при катализе серной или фосфорной кислотами, оксидом алюминия или хлоридом цинка:
При дегидратации спиртов атом водорода наиболее легко отщепляется от наименее гидрогенизированного атома углерода (правило Зайцева):
Алкены образуются при действии на галоидные алкилы спиртовой или измельченной твердой щелочи. Эта реакция дегидрогалогенирования также идет по правилу Зайцева:
Алкены можно получить обработкой цинковым или магниевым порошком вицинальных дигалоидалканов:
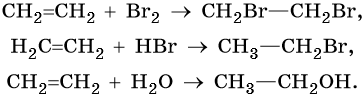
Алкены вступают в реакции соединения по двойной связи. Они протекают по механизму электрофильного присоединения, или AE. Присоединение галогеноводородов и воды к несимметричным алкенам идет по правилу Марковникова: атом водорода присоединяется к наиболее гидрогенизированному, т. е. связанному с наибольшим числом водородных атомов, атому углерода. По легкости присоединения к алкенам галогеноводороды можно расположить в ряд: HI > HBr > HCl > HF.
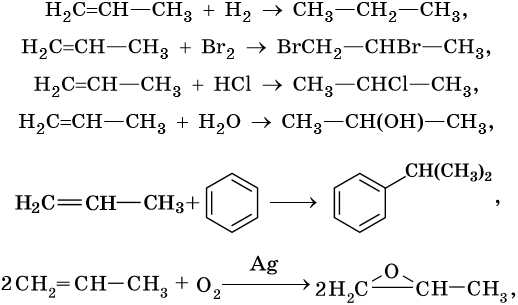
Ниже приведены реакции алкенов на примере этена и пропена:
Этен:
Реакция гидратации катализируется кислотами.
Пропен:
Реакция алкилирования протекает между алканами и алкенами в присутствии катализаторов:
Кроме реакций соединения для алкенов возможны отдельные реакции замещения, которые протекают по радикальному механизму, а также реакции разложения:
C позиции электронной теории правило Марковникова объясняют так: под действием метильного радикала в молекуле пропилена происходит перераспределение электронной плотности электронного облака π-связи в сторону крайнего ненасыщенного атома углерода, в результате чего на атомах углерода, связанных двойной связью, возникают частичные заряды:
При взаимодействии такой молекулы с галогенводородом присоединение положительно заряженного иона водорода идет по атому углерода с частичным отрицательным зарядом, а отрицательно заряженного галогенидиона — по атому углерода с частичным положительным зарядом.
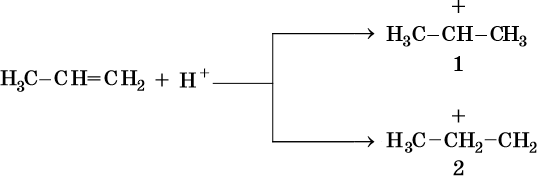
Другое объяснение правила Марковникова следующее. В результате электрофильного присоединения возможно образование двух различных карбокатионов: из-за положительного индуктивного эффекта двух метильных групп карбокатион 1 более стабилен, чем карбокатион 2.
Таким образом, реакции электрофильного присоединения по двойной связи идут в направлении образования наиболее устойчивого промежуточного карбокатиона.
Существуют исключения из правила Марковникова. Это присоединение бромоводорода к алкенам в присутствии органических пероксидов или кислорода. В этом случае из пропена и бромоводорода образуется 1-бромпропан (перекисный эффект Хараша). Подчеркнем особо: перекисный эффект имеет место только в случае реакции алкенов с бромоводородом. При присоединении к алкенам HCl, H2O, HI пероксиды не влияют на направление реакции, и она идет по правилу Марковникова.
Диеновыми углеводородами называют класс химических соединений, молекулы которых отвечают общей формуле CnH2n–2 и содержат в своем составе две двойные углерод-углеродные связи. Для диенов характерна изомерия углеродного скелета, изомерия положения кратных связей, геометрическая изомерия, а также межклассовая изомерия с ацетиленовыми углеводородами.
Способы получения диенов. Дивинил и изопрен выделяют из продуктов пиролиза нефти. Основным промышленным способом получения бутадиена-1,3 является дегидрирование бутан-бутеновой смеси над катализатором, состоящим из окиси хрома, нанесенной на окись алюминия.
Метод получения дивинила по С.В. Лебедеву заключается в дегидрировании-дегидратации этилового спирта над катализатором MoO — ZnO при 450 °С.
Диены, у которых двойные связи разделены более чем одной одинарной связью, в химическом отношении ведут себя подобно алкенам.
Диены, у которых двойные связи разделены одной простой связью, называют конъюгированными или сопряженными диенами. Эти соединения обладают специфическими химическими свойствами и имеют важное практическое значение.
Своеобразные химические свойства диенов проявляются в реакциях присоединения, которые идут не только по одной или двум отдельным двойным связям (1,2-присоединение), но и по противоположным концам молекулы (1,4-присоединение). Выход продуктов 1,2- или 1,4-присоединения определяется характером реагента и условиями реакции.
При низких температурах преобладают продукты 1,2-присоединения, при повышенных — 1,4-присоединения.
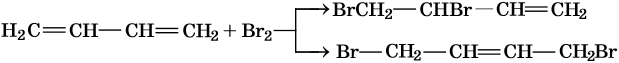
Полное бромирование бутадиена-1,3 приведет к 1,2,3,4-тетрабромбутану:
Неполное гидрирование диенов приводит к смеси алкенов, а при полном образуются алканы:
Окисление сопряженных диенов, в зависимости от используемого окислителя и условий проведения реакции, может протекать с образованием различных кислородсодержащих соединений. При частичном окислении в нейтральной среде образуется щавелевая кислота, а действие перманганата калия в кислой среде при нагревании приведет к полному окислению диена до углекислого газа и воды.
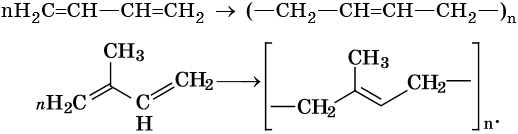
Полимеризация диенов:
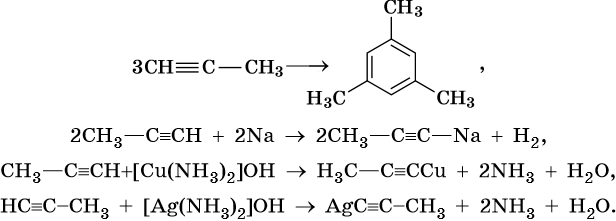
Ацетиленовыми углеводородами, или алкинами, называют класс органических соединений, которые соответствуют общей формуле CnH2n–2 и содержат в молекуле одну тройную связь. Родоначальником этого класса соединений является ацетилен, или этин, — HC≡CH. Для ацетиленовых углеводородов характерна изомерия углеродной цепи, изомерия положения кратной связи и межклассовая изомерия с диеновыми углеводородами.
Общим методом получения алкинов является реакция спиртовых растворов щелочи с дигалоидалканами, содержащими два атома галогена при одном атоме углерода или двух соседних атомах углерода:
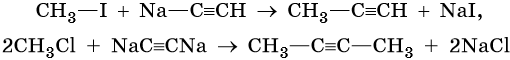
Производные ацетилена можно получить, действуя на его металлические производные галоидными алкилами:
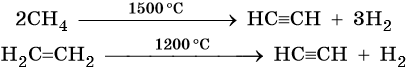
Ацетилен получают действием воды на карбид кальция:
Кроме того, ацетилен получают термолизом метана и дегидрированием этилена:
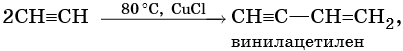
Для алкинов характерны реакции соединения и некоторые реакции замещения, которые приведены ниже на примере ацетилена и пропина. Катализаторами для реакций гидрирования алкинов являются Pd или PbO. Следует отметить, что реакции галогенирования и гидрогалогенирования алкинов идут медленнее, чем с алкенами.
Ацетилен:
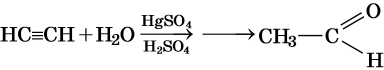
Реакция Кучерова:
Реакции винилирования:
Реакции ди- и тримеризации:
Реакции замещения:
Реакции окисления:
Пропин:
Тримеризация:
Ароматическими углеводородами, или аренами, называют класс химических соединений, который отвечает общей формуле CnH2n–6 и имеет в своем составе устойчивую циклическую группировку (бензольное кольцо), обладающую особыми химическими свойствами.
Получение ароматических углеводородов. Основным природным источником ароматических углеводородов является нефть. Для получения гомологов бензола разработаны многочисленные синтетические методы.
Некоторые сорта нефти содержат достаточное количество ароматических углеводородов, которые выделяют простой перегонкой, пиролизом или каталитическим крекингом.
Синтетические методы — это ароматизация алканов, алкилирование бензола и т.д.
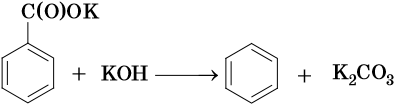
Так, например, бензол можно получить реакцией декарбоксилирования бензоата натрия или калия:
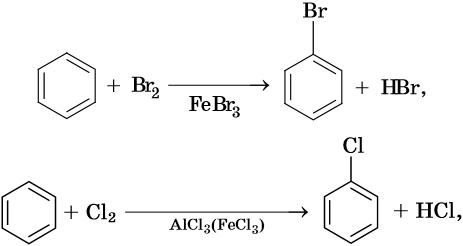
Для ароматических углеводородов наиболее характерны реакции замещения и некоторые реакции присоединения.
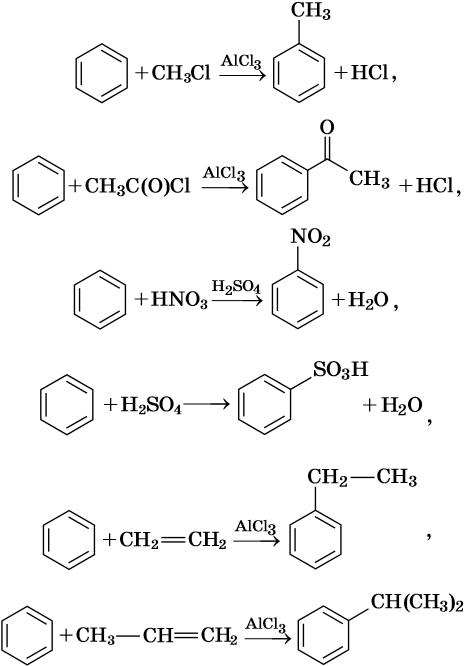
Как правило, все реакции замещения в ароматических соединениях протекают по электрофильному механизму SE. К таким реакциям относятся реакции алкилирования, галогенирования, нитрования, сульфирования, ацилирования и другие. Характерные химические свойства бензола:
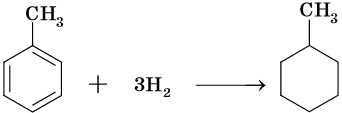
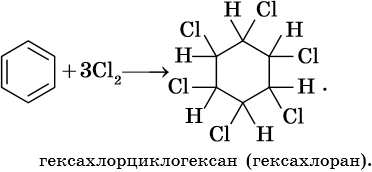
Гидрирование бензола до циклогексана идет при повышенной температуре, в присутствие катализатора (никель, платина), а хлорирование до гексахлорциклогексана — в газовой фазе под ультрафиолетовым излучением.
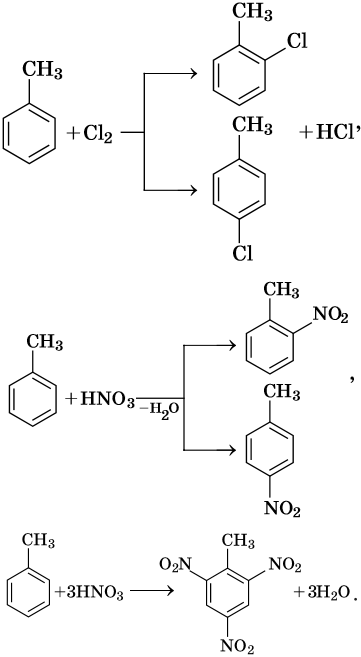
В молекуле толуола проявляется взаимное влияние метильного радикала на ароматическое ядро и ароматического ядра на метильный радикал. Толуол вступает в реакции замещения легче, чем бензол. При этом метильная группа ориентирует вхождение заместителей в орто— и пара-положения:
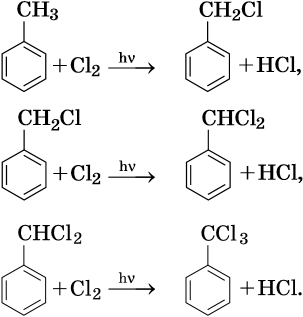
Галогенирование атомов водорода боковой цепи:
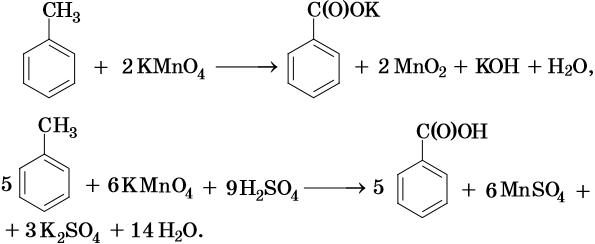
Окисление метильного радикала сильными окислителями, в зависимости от среды реакции, идет по разным направлениям:
В ходе реакций окисления алкилбензолов происходит окисление боковой цепи, а бензольное кольцо изменений не претерпевает:
Исключением являются третбутильные группы, связанные с бензольным кольцом — бензольное кольцо окисляется легче, чем эти группы.
При окислении жирноароматических соединений, содержащих ненасыщенные радикалы, соблюдаются общие закономерности, например:
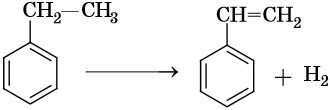
Этилбензол вступает в реакцию дегидрирования с образованием стирола:
Реакция протекает с высоким (92%) выходом при катализе оксидом цинка при температуре 600–650 °С.
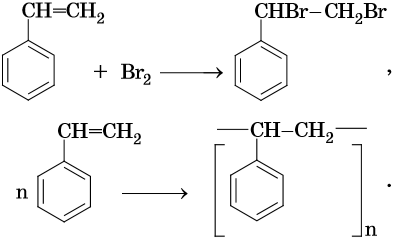
Стирол легко вступает в реакции по двойной связи и в реакции полимеризации и сополимеризации:
Свойства бутадиен-стирольных каучуков зависят от их состава. На их основе изготавливают шины и другие резинотехнические изделия.