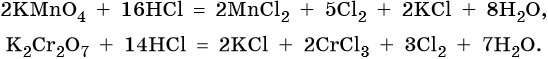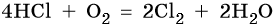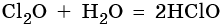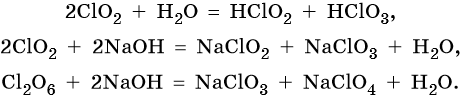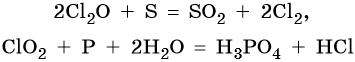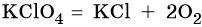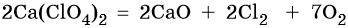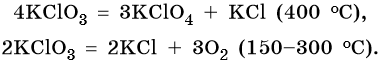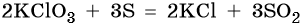Элементы группы VIIА

В группе VIIА находятся фтор F, хлор Cl, бром Br, йод I и астат At. Эти элементы называют также галогенами (в переводе — рождающие соли).
На внешнем энергетическом уровне всех этих элементов находятся 7 электронов (конфигурации ns2np5), наиболее характерные степени окисления –1, +1, +5 и +7 (кроме фтора).
Атомы всех галогенов образуют простые вещества состава Hal2.
Галогены являются типичными неметаллами. При переходе от фтора к астату происходит увеличение радиуса атома, неметаллические свойства падают, происходит уменьшение окислительных и увеличение восстановительных свойств.
В промышленности фтор получают электролизом расплавов KF·HF или KF·2HF, хлор — электролизом водных растворов хлоридов щелочных металлов, а бром и йод — окислением бромидов и йодидов природной воды хлором.
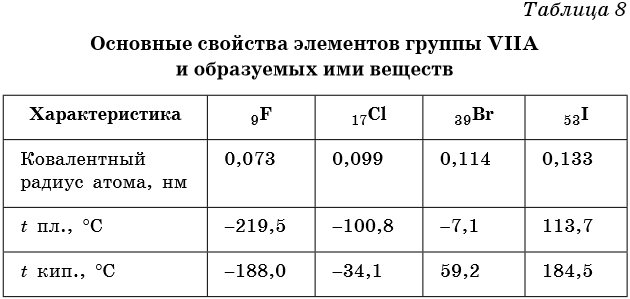
Физические свойства галогенов приведены в таблице 8.
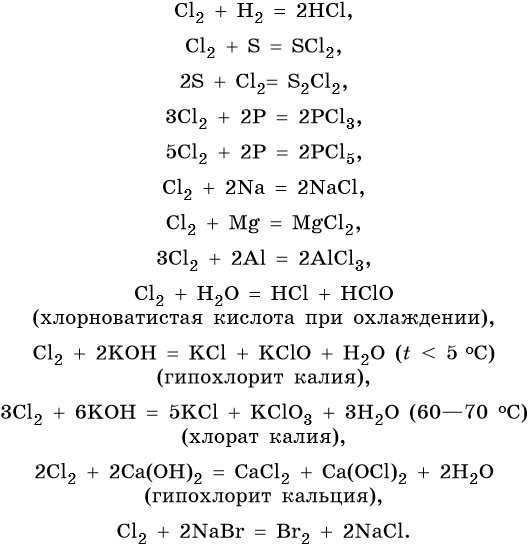
В химическом отношении галогены весьма активны. Их реакционная способность убывает с увеличением порядкового номера. Некоторые характерные для них реакции приведены ниже на примере хлора:
Водородные соединения галогенов — галогеноводороды имеют общую формулу HHal. Их водные растворы являются кислотами, сила которых возрастает от HF к HI.
Галогенводородные кислоты (за исключением HF) способны реагировать с такими сильными окислителями, как KMnO4, MnO2, K2Cr2O7, CrO3 и другими с образованием галогенов:
В присутствии катализаторов (например, CuCl2) хлороводород реагирует с кислородом с образованием хлора и воды:
Эту реакцию используют в промышленности для регенерации хлора при производстве хлорорганических веществ.
Галогены образуют ряд оксидов, например, для хлора известны кислотные оксиды состава Cl2O, ClO2, ClO3, Cl2O7. Все эти соединения получают косвенными методами. Они являются сильными окислителями и взрывоопасными веществами.
Наиболее устойчивым из оксидов хлора является Cl2O7. Оксиды хлора легко реагируют с водой, образуя кислородосодержащие кислоты: хлороватистую HClO, хлористую HClO2, хлорноватую HClO3 и хлорную HClO4, например:
Оксиды хлора (IV) и (VI) при взаимодействии с водой и щелочами диспропорционируют:
Оксиды хлора являются сильными окислителями, что можно проиллюстрировать с помощью следующих реакций:
Кислородсодержащие кислоты хлора являются не слишком устойчивыми соединениями, все они за исключением хлорной кислоты существуют только в растворе. При этом водные растворы HClO и HClO2 являются слабыми кислотами, а водные растворы HClO3 и HClO4 — сильными кислотами.
Кислородосодержащие кислоты хлора образуют соответствующие соли: гипохлориты, хлориты, хлораты и перхлораты. Соли хлорноватистой кислоты (гипохлориты) и хлористой (хлориты) в свободном состоянии неустойчивы и являются сильными окислителями в водных растворах. Растворы хлоратов и перхлоратов щелочных металлов, напротив, устойчивы и в растворах не проявляют окислительных свойств. Хлораты и перхлораты могут быть выделены в свободном состоянии.
При нагревании все перхлораты разлагаются с выделением кислорода, например:
При разложении перхлоратов лития, натрия, щелочноземельных металлов одновременно протекает другая реакция, например:
Перхлораты очень гигроскопичны. Их используют как осушители и окислители ракетного топлива.
Хлораты разлагаются легче перхлоратов. Реакция в зависимости от температуры может идти по-разному:
В твердом состоянии хлораты вступают в реакции с восстановителями при инициировании трением или ударом, при этом реакция может протекать со взрывом. Это свойство хлоратов используют в спичечной промышленности и в пиротехнике, например: