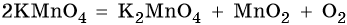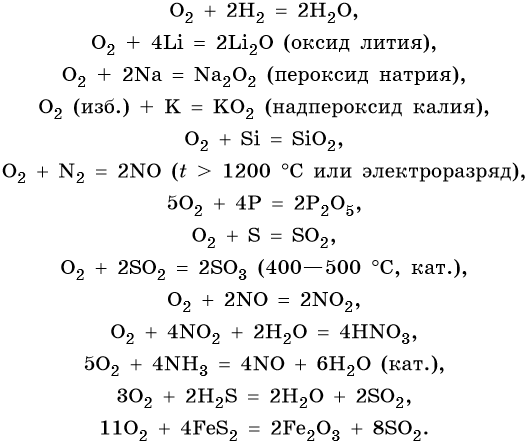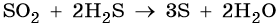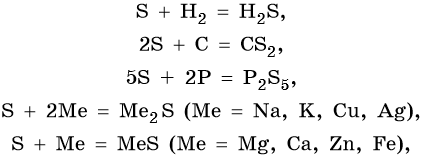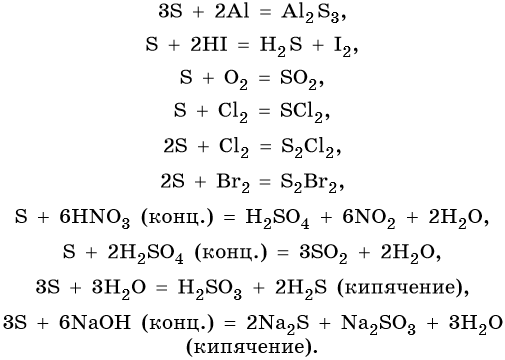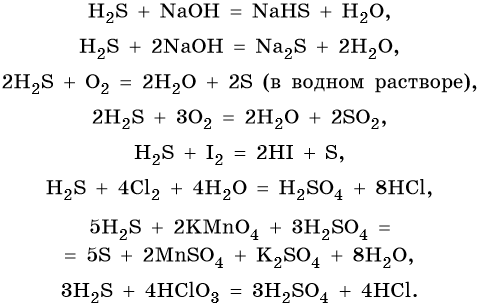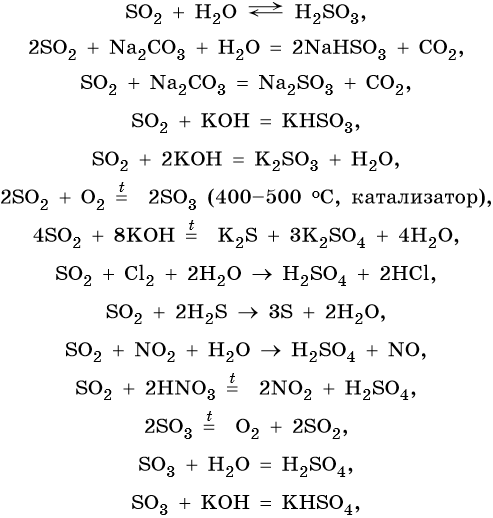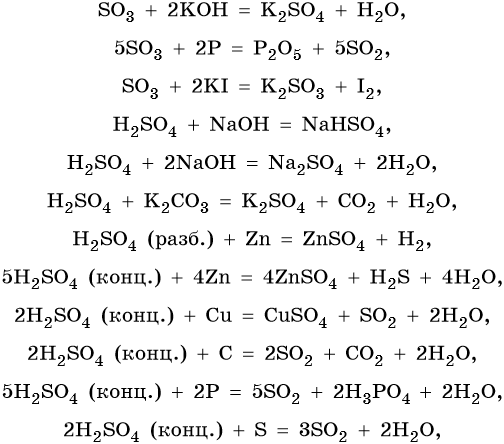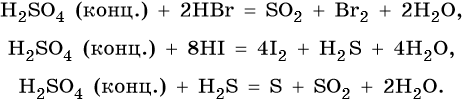Элементы группы VIA

В группе VIА Периодической системы Д. И. Менделеева, которую называют также подгруппой кислорода, находятся пять элементов: кислород O, сера S, теллур Te и полоний Po. Другое название этих элементов халькогены, что в переводе на русский язык означает «образующие руды». Внешние электронные уровни халькогенов содержат 6 электронов и имеют конфигурацию ns2np4.
Наиболее характерные степени окисления халькогенов –2, +4, +6. Исключением является кислород, для которого характерна степень окисления –2 и –1 в пероксидах.
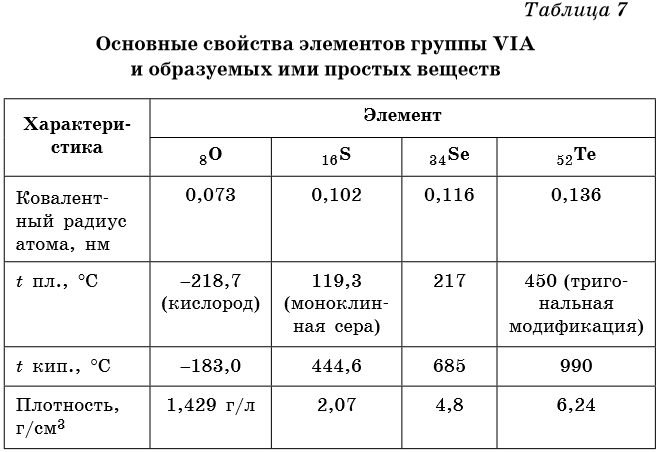
Все элементы подгруппы кислорода, за исключением полония, являются неметаллами. Некоторые физические свойства халькогенов приведены в таблице 7.
Кислород. В свободном состоянии кислород встречается в виде двух аллотропных модификаций: кислород О2 и озон О3 (аллотропия состава).
В промышленности кислород получают ректификацией жидкого воздуха, а в лаборатории — разложением перманганата калия или хлората калия, например:
Простое вещество кислород представляет собой бесцветный газ, без вкуса и запаха, малорастворимый в воде.
Озон представляет собой газ синего цвета, с резким раздражающим запахом, t кип. –111,9 °С. По сравнению с кислородом озон лучше растворим в воде.
Характерные химические свойства кислорода:
Cера. Неметалл желтого цвета. В промышленности серу получают выплавкой самородной серы, а также из газов металлургических, коксовых и иных производств:
Существует в двух аллотропных модификациях: ромбическая и моноклинная и в аморфной форме (пластическая сера). Проявляет как окислительные, так и восстановительные свойства. Возможны реакции диспропорционирования. Ее характерные химические свойства:
Сера образует летучее водородное соединение — сероводород. Его водный раствор представляет собой слабую двухосновную кислоту. Для сероводорода характерны также восстановительные свойства:
Сера образует два кислотных оксида: оксид серы (IV) SO2 и оксид серы (VI) SO3. Первому соответствует существующая только в растворе сернистая кислота H2SO3, являющаяся кислотой средней силы; второму — сильная двухосновная серная кислота H2SO4. Концентрированная серная кислота проявляет сильные окислительные свойства. Ниже приведены характерные для этих соединений реакции: