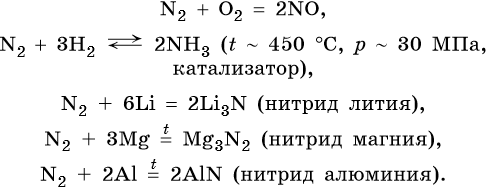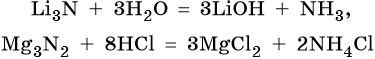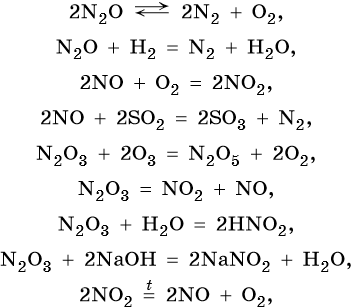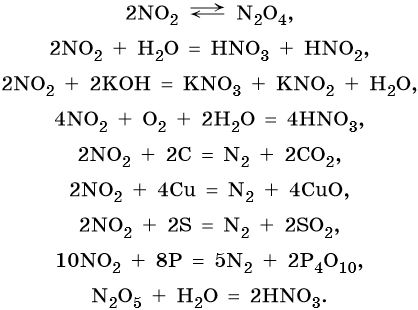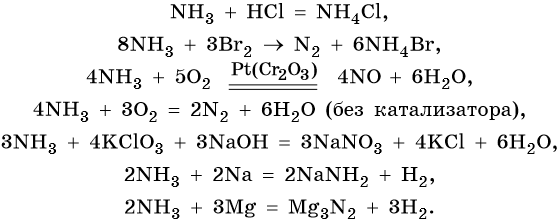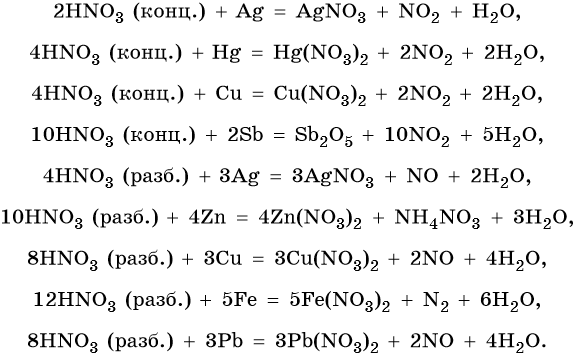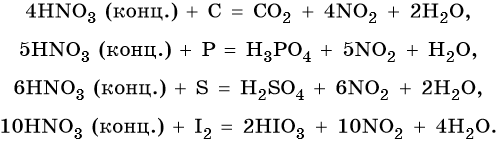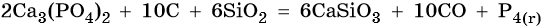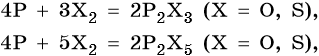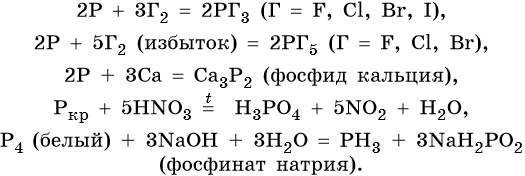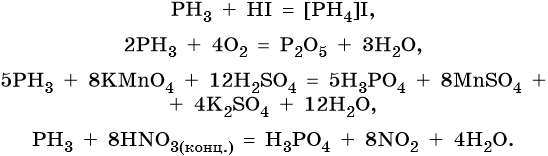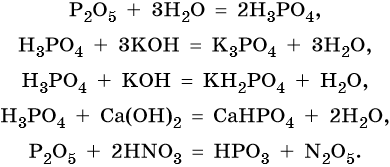Элементы группы VA

Неметаллами в группе VА Периодической системы Д.И. Менделеева являются азот N и фосфор Р; мышьяк As и сурьма Sb проявляют как металлические, так и неметаллические свойства; висмут Bi является типичным металлом. На внешнем энергетическом уровне всех этих элементов находятся 5 электронов (конфигурации ns2np3), наиболее характерные степени окисления –3, +3 и +5.
Азот проявляет в своих соединениях степени окисления –3, +1, +2, +3, +4 и +5.
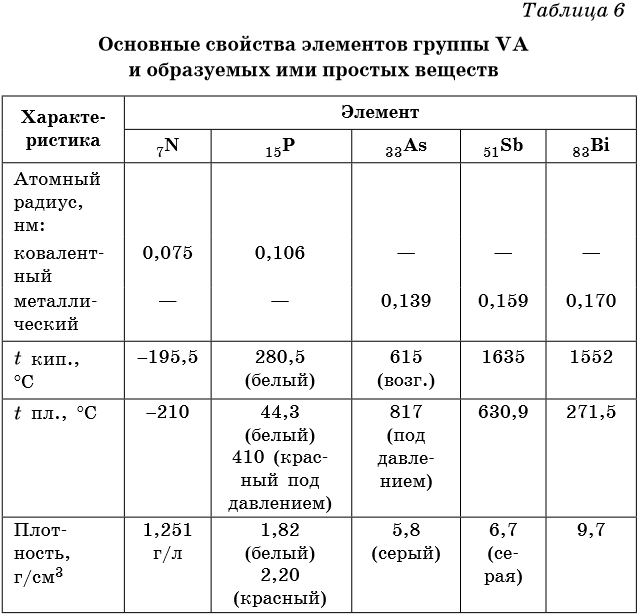
Некоторые сведения о физических свойствах этих элементов приведены в таблице 6.
Азот. Газ без цвета и запаха, малорастворимый в воде. Типичный неметалл. Основной компонент атмосферы. В промышленности азот получают ректификацией жидкого воздуха. В обычных условиях химически мало активен. При нагревании вступает в окислительно-восстановительные реакции.
Нитриды реагируют с водой с образованием соответствующих гидроксидов и аммиака, а при их взаимодействии с кислотами образуется смесь солей:
Азот образует оксиды состава N2O, NO, N2O3, NO2, N2O4, N2O5. При этом N2O, NO являются несолеобразующими оксидами, для которых характерны окислительно-восстановительные реакции; N2O3, NO2, N2O4, N2O5 — солеобразующие кислотные оксиды, для которых также характерны окислительно-восстановительные реакции, в том числе — реакции диспропорционирования.
Химические свойства оксидов азота:
Азот образует летучее водородное соединение состава NH3, аммиак. При обычных условиях это бесцветный газ с характерным резким запахом; t кип. –33,7 °C, t пл. –77,8 °C. Аммиак хорошо растворим в воде (700 объемов NH3 на 1 объем воды при 20 °C) и ряде органических растворителей (спирт, ацетон, хлороформ, бензол).
Химические свойства аммиака:
Азот образует азотистую кислоту HNO2 (в свободном виде известна только в газовой фазе или растворах). Это кислота средней силы, ее соли называют нитритами.
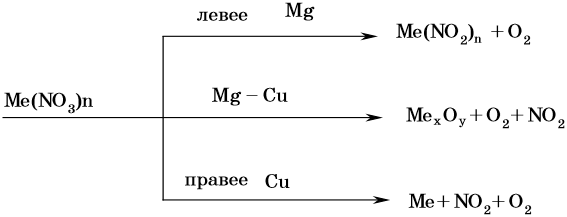
Кроме того, азот образует очень сильную азотную кислоту HNO3. Концентрированная азотная кислота пассивирует некоторые металлы (железо, алюминий, хром). Особенностью азотной кислоты является то, что при ее окислительно-восстановительных реакциях с металлами не выделяется водород, а образуются различные оксиды азота или соли аммония. Продукты восстановления зависят от природы восстановителя и от концентрации кислоты. В целом чем выше концентрация HNO3, тем меньше она восстанавливается.
Ниже приведены реакции, характеризующие ее свойства:
В реакциях с неметаллами концентрированная азотная кислота ведет себя как сильный окислитель:
Также азотная кислота способна окислять сульфиды, йодоводород и т.д.:
Подчеркнем еще раз. Запись уравнений окислительновосстановительных реакций с участием HNO3 обычно условна. Как правило, в них указывают лишь продукт, образующийся в большем количестве. В некоторых из таких реакций в качестве продукта восстановления обнаружен водород (реакция разбавленной HNO3 с Mg и Mn).
Различные случаи термического разложения нитратов:
Особые случаи разложения нитрата аммония:
Фосфор. Существует в виде нескольких аллотропных модификаций (аллотропия состава). Белый фосфор Р4, метастабильный, при комнатной температуре мягкий, плавится, кипит без разложения. Красный фосфор Pn, состоит из полимерных молекул разной длины. При нагревании возгоняется. Черный фосфор состоит из непрерывных цепей Pn, имеет слоистую структуру, по внешнему виду похож на графит. Наиболее реакционноспособным является белый фосфор.
В промышленности фосфор получают прокаливанием фосфата кальция с углем и песком при 1500 °C:
В приведенные ниже реакции вступают любые модификации фосфора, если нет особых оговорок:
Фосфор образует летучее водородное соединение — фосфин, PH3. Это газообразное соединение с крайне неприятным резким запахом. Его соли в отличие от солей аммиака существуют только при низких температурах. Фосфин легко вступает в окислительно-восстановительные реакции:
Фосфор образует два кислотных оксида: P2O3 и P2O5. Последнему соответствует фосфорная (ортофосфорная) кислота H3PO4. Это трехосновная кислота средней силы, которая образует три ряда солей: средние (фосфаты) и кислые (гидро- и дигидрофосфаты). Ниже приведены уравнения химических реакций, характерные для данных соединений: