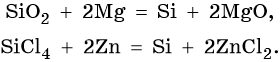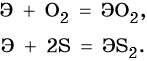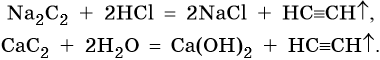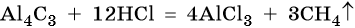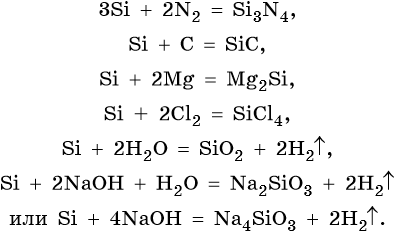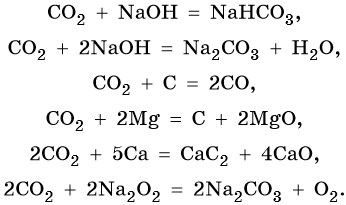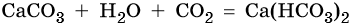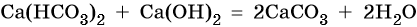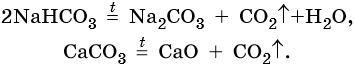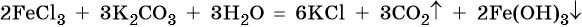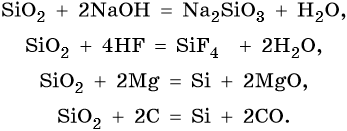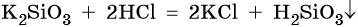Элементы группы IVA

Неметаллами в группе IVA Периодической системы Д.И. Менделеева являются углерод C, кремний Si. Кроме того, в нее входят германий Ge, олово Sn и свинец Pb.
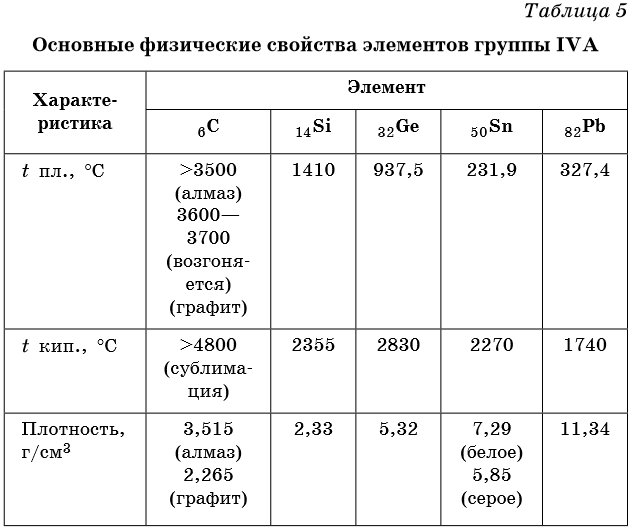
На внешнем энергетическом уровне всех этих элементов находятся 4 электрона (конфигурации ns2np2), наиболее характерные степени окисления — +2 и +4. В органических соединениях углерод может проявлять степени окисления от –4 до +4. С увеличением атомного номера возрастают радиусы нейтральных атомов, уменьшается энергия ионизации, ослабевают неметаллические свойства элементов и усиливаются металлические. Так, углерод и кремний — типичные неметаллы, а олово и свинец — металлы.
Некоторые физические характеристики этих элементов приведены в таблице 5.
С увеличением атомного номера ослабевают неметаллические свойства элементов и усиливаются металлические.
Для углерода известны стабильные аллотропные модификации (графит, алмаз), в виде которых он встречается в природе, а также полученные лабораторным путем карбин и фуллерены. Кремний получают восстановлением его оксида магнием или углеродом в электрических печах, а кремний высокой чистоты — восстановлением SiCl4 цинком или водородом, например:
Кремний может существовать в кристаллической или аморфной форме. Для кремния наиболее устойчива степень окисления +4.
Ниже приведены уравнения реакций, общие для углерода и кремния (Э = C, Si):
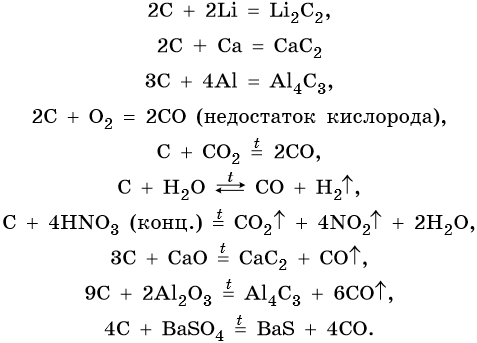
В реакциях с другими простыми и сложными веществами свойства углерода и кремния отличаются. Реакции, характерные для углерода:
Карбиды щелочных и щелочноземельных металлов являются ацетелинидами, т. е. при их взаимодействии с водой или кислотами образуется ацетилен, например:
Карбид алюминия относят к метанидам: при его взаимодействии с водой или кислотами выделяется метан:
Реакции, характерные для кремния:
Углерод и кремний образуют кислотные оксиды общей формулы ЭО2, а также летучие водородные соединения общей формулы ЭН4.
Свойства оксида углерода (IV):
Оксиду углерода (IV) соответствует очень слабая двухосновная угольная кислота H2CO3, которая не существует в чистом виде. Она образует два ряда солей: средние — карбонаты, например карбонат кальция CaCO3, и кислые — гидрокарбонаты, например Ca(HCO3)2 — гидрокарбонат кальция.
Карбонаты переходят в гидрокарбонаты под действием избытка углекислого газа в водной среде:
Гидрокарбонат кальция превращается в карбонат под действием гидроксида кальция:
Гидрокарбонаты и карбонаты разлагаются при нагревании:
Карбонаты ряда металлов (алюминия, железа (III), хрома (III) не существуют. При попытке их получения реакциями обмена образуются углекислый газ и гидроксид соответствующего металла, например:
Свойства оксида кремния (IV):
Кремний образует кислоты переменного содержания SiO2 и H2O. Соединение состава H2SiO3 в чистом виде не выделено, но для упрощения допускается его запись в уравнениях реакций: