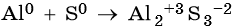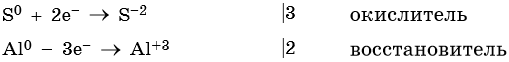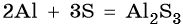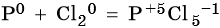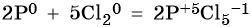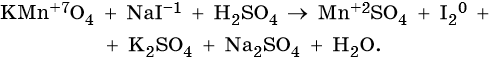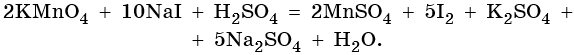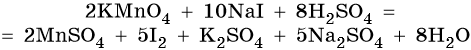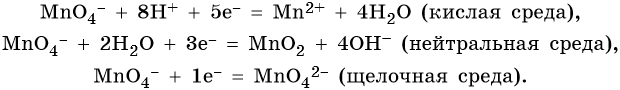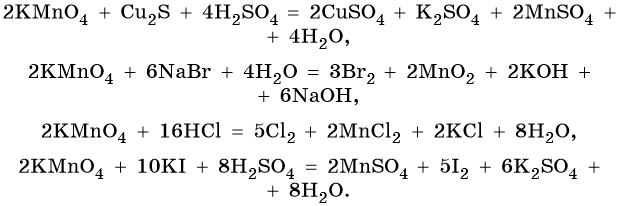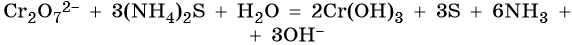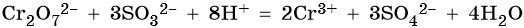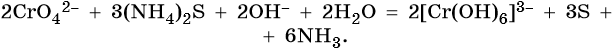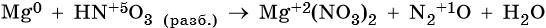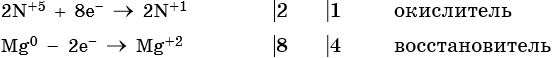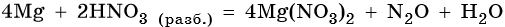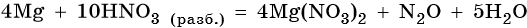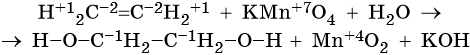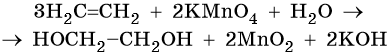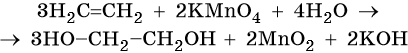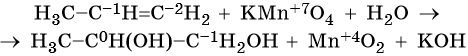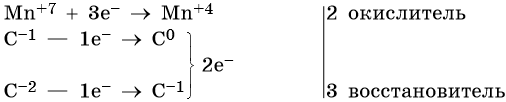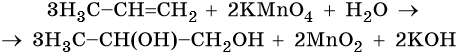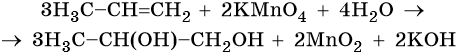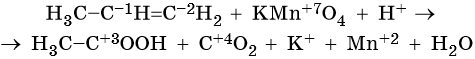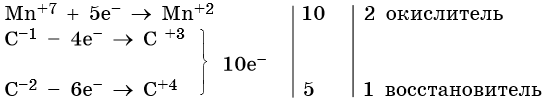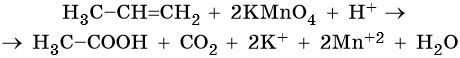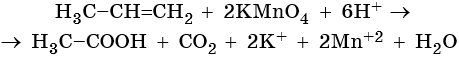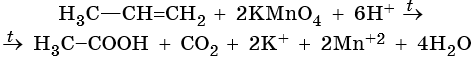Окислительно-восстановительные реакции

Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. (Легко запомнить: окислитель — грабитель.)
Восстановителем называют реагент, который отдает электроны в ходе окислительно-восстановительной реакции.
Окислительно-восстановительные реакции делят на реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Для составления окислительно-восстановительных реакций используют метод электронного баланса.
Составление уравнения окислительно-восстановительной реакции осуществляют в несколько стадий.
- Записывают схему уравнения с указанием в левой и правой частях степеней окисления атомов элементов, участвующих в процессах окисления и восстановления.
- Определяют число электронов, приобретаемых или отдаваемых атомами или ионами.
- Уравнивают число присоединенных и отданных электронов введением множителей, исходя из наименьшего кратного для коэффициентов в процессах окисления и восстановления.
- Найденные коэффициенты (их называют основными) подставляют в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Пример 1. Реакция алюминия с серой. Записываем схему реакции и указываем изменение степеней окисления:
Атом серы присоединяет два электрона, изменяя свою степень окисления от 0 до –2. Он является окислителем.
Атом алюминия отдает три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 2. Окисление фосфора хлором. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления хлора изменяется от 0 до –1, при этом молекула хлора присоединяет два электрона. Хлор является окислителем.
Атом фосфора отдает пять электронов, изменяя свою степень окисления от 0 до +5. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
Электронное уравнение для хлора записывают именно так, поскольку окислителем является молекула хлора, состоящая из двух атомов, и каждый из этих атомов изменяет свою степень окисления от 0 до –1. Коэффициент 5 относится к молекуле хлора в левой части уравнения, а количество атомов хлора в правой части уравнения 5 × 2 = 10.
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Очень часто окислительно-восстановительные реакции проходят в растворах в нейтральной, кислой или щелочной среде. В этом случае химические элементы, входящие в состав вещества, образующего среду реакции, свою степень окисления не меняют.
Пример 3. Окисление йодида натрия перманганатом калия в среде серной кислоты. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Атом марганца принимает пять электронов, изменяя свою степень окисления от +7 до +2. Перманганат калия является окислителем.
Два йодид-иона отдают два электрона, образуя молекулу I20. Йодид натрия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов введением множителей:
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Серная кислота является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет, но сульфат-анион связывает выделяющиеся в результате реакции катионы калия, натрия и марганца. Подсчитаем число сульфат-ионов в правой части. Оно равно 2 + 1 + 5 = 8. Следовательно, перед серной кислотой следует поставить коэффициент 8. Число атомов водорода в левой части уравнения равно 8 × 2 = 16. Отсюда вычисляем коэффициент для воды: 16/2 = 8.
Таким образом, уравнение реакции будет иметь вид:
Правильность баланса проверяем по кислороду. В левой части его 2 × 4 = 8 (перманганат калия); в правой — 8 × 1 = 8 (вода). Следовательно, уравнение составлено правильно.
Некоторые важнейшие окислители:
Перманганат калия. Является сильным окислителем, широко применяется в лабораторной практике. Характер восстановления перманганата калия зависит от среды, в которой протекает реакция. В кислой среде перманганат калия восстанавливается до солей Mn2+, в нейтральной или слабощелочной — до MnO2, а в сильнощелочной он переходит в манганат-ион MnO42–. Данные переходы описываются следующими уравнениями:
Перманганат калия способен окислять сульфиды в сульфаты, нитриты в нитраты, йодиды до свободного йода, соляную кислоту до хлора и т. д.:
Хромат и бихромат калия. Эти соединения широко применяют в качестве окислителей в неорганических и органических синтезах. Взаимные переходы хромат- и бихромат-ионов очень легко протекают в растворах, что можно описать следующим уравнением обратимой реакции:
Соединения хрома (VI) — сильные окислители. В окислительно-восстановительных процессах они переходят в производные Cr (III). В нейтральной среде образуется гидроксид хрома (III), например:
В кислой среде образуются ионы Cr3+:
В щелочной — производные анионного комплекса [Cr(OH)6]3–:
Довольно часто одно и то же вещество одновременно является окислителем и создает среду реакции. Такие реакции характерны для концентрированной серной и азотной кислот в любой концентрации. Кроме того, в подобные реакции, но в качестве восстановителя вступают галогенводородные кислоты с сильными окислителями.
Пример 4. Окисление магния разбавленной азотной кислотой. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления азота изменяется от +5 до +1, при этом два атома азота присоединяют десять электронов. Азотная кислота является окислителем.
Магний отдает два электрона, изменяя свою степень окисления от 0 до +2. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 4 × 2 = 8 нитрат-ионов, не изменивших свою степень окисления. Очевидно, что для этого в правую часть уравнения реакции следует добавить еще 8 молекул HNO3. Тогда общее количество молекул азотной кислоты в правой части уравнения составит 2 + 8 = 10.
В этих молекулах содержатся 10 × 1 = 10 атомов водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Следовательно, перед молекулой воды следует подставить коэффициент 10/2 = 5, и уравнение окончательно будет иметь вид:
Окончательно проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части 10 × 3 = 30. В правой части (2 × 3) × 4 = 24 в нитрате магния, 1 в оксиде азота (I) и 5 × 1 = 5 в молекуле воды. Итого 24 + 1 + 5 = 30. Таким образом, реакция полностью уравнена.
Окислительно-восстановительные реакции с участием органических соединений вызывают определенные сложности, но и в этом случае понятие «степень окисления», несмотря на свой формальный характер, позволяет уравнивать любые реакции. При этом для определения заряда на атоме углерода следует помнить, что атом водорода в молекулах органических веществ всегда имеет заряд +1, а атом кислорода –2.
Пример 5. Окисление этена перманганатом калия в нейтральной среде. Записываем схему реакции и указываем изменение степеней окисления:
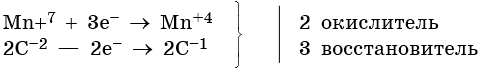
Марганец присоединяет три электрона, изменяя свою степень окисления с +7 до +4.
Атом марганца в молекуле перманганата калия является окислителем. Два атома углерода в молекуле этена отдают два электрона, изменяя свою степень окисления с –2 до –1. Атомы углерода являются восстановителями.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
Подставляем найденные коэффициенты в уравнение реакции перед соответствующими формулами веществ в левой и правой частях:
Подсчитываем число атомов водорода в правой части. Оно складывается из 3 × 2 = 6 в молекуле этиленгликоля и 2 в гидроксиде калия, итого 8.
Отсюда следует, что перед молекулой воды в левой части необходимо поставить коэффициент 8/2 = 4.
Окончательно проверяем правильность составления уравнения, сравнивая число атомов кислорода в левой и правой частях уравнения. Оно равно 12.
Пример 6. Окисление пропена перманганатом калия в водной среде. Записываем схему реакции и указываем изменение степеней окисления:
Атом марганца принимает три электрона, изменяя свою степень окисления от +7 до +4. Перманганат калия является окислителем. Восстановителями являются два атома углерода в молекуле пропена. Оба отдают по одному электрону. Пропен является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов введением множителей:
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях:
Подсчитываем число атомов водорода в правой части. Оно равно 3 × 2 = 6 в молекуле пропандиола-1,2 и 2 в молекуле KOH, итого 8. Число атомов водорода в углеродном скелете молекулы не учитываем, так как оно осталось неизменным. Следовательно, перед молекулой воды в левой части нужно поставить коэффициент 4.
Окончательно проверяем правильность составления уравнения, сравнивая число атомов кислорода в левой и правой частях уравнения. Оно равно 12.
Иногда окислительно-восстановительные реакции усложняют, указав, что реакция идет в кислой среде, не указывая при этом конкретную формулу кислоты. В этом случае соблюдают баланс как по числу химических элементов, так и по количеству зарядов в левой и правой частях уравнения.
Пример 7. Взаимодействие пропена с перманганатом калия в кислой среде при нагревании. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Атом марганца принимает пять электронов, изменяя свою степень окисления от +7 до +2. Перманганат калия является окислителем. Восстановителями являются два атома углерода в молекуле пропена. Первый, из фрагмента –С–1H=, переходит в карбоксильную группу –C+3OOH, отдавая при этом четыре электрона. Второй, из фрагмента =C–2H2, переходит в углекислый газ C+4O2, отдавая при этом шесть электронов.
Составляем уравнения электронного баланса и уравниваем число присоединенных и отданных электронов введением множителей:
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях:
Реакция протекает в кислой среде. Число положительных зарядов в правой части уравнения равно шести (2 × 1 + 2 × 2). Следовательно, именно этот коэффициент следует проставить перед катионом H+ в левой части уравнения.
Вычислим коэффициент перед формулой воды. Он складывается из шести (катионы водорода среды) и двух (атомы водорода фрагмента =CH2), итого 8/2 = 4.
Таким образом, уравнение реакции будет иметь вид:
Правильность баланса проверяем по кислороду. В левой части его 2 × 4 = 8. В правой 1 × 2 + 1 × 2 + 4 × 1 = 8. Следовательно, уравнение составлено правильно.
Окислительно-восстановительные реакции с участием органических соединений практически всегда встречаются в заданиях, посвященных реакциям, подтверждающим взаимосвязь органических соединений.
Наиболее сложные из них представлены в уроках с тренировочными заданиями в форме ЕГЭ (уроки 32-40).