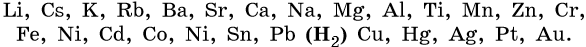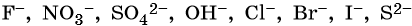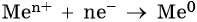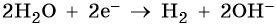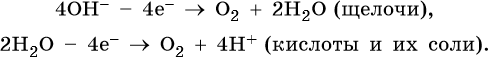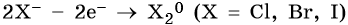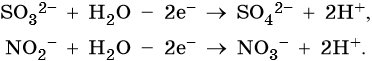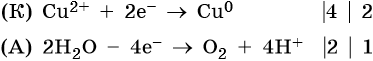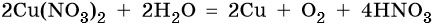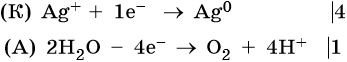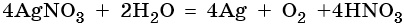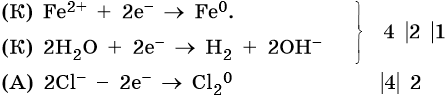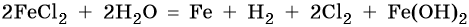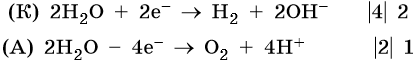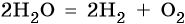Электролиз

Электролизом называют химические реакции, которые протекают под действием электрического тока на электродах в растворах и расплавах электролитов.
Катодом называют отрицательно заряженный электрод. На его поверхности ионы, молекулы или атомы присоединяют электроны, т. е. протекает реакция электрохимического восстановления катионов.
Анодом называют положительно заряженный электрод. На его поверхности происходит отдача электронов, т. е. реакция окисления.
Для установления продуктов электролиза водных растворов солей используют так называемый электрохимический ряд напряжений металлов, а также ряд восстановительной активности анионов.
Электрохимический ряд напряжений металлов:
Ряд восстановительной активности анионов:
Рассмотрим несколько примеров реакций электролиза, протекающих на инертных, т.е. не вступающих в какие-либо химические реакции, электродах.
Прогнозировать происходящие при электролизе водных растворов процессы можно с помощью ряда напряжений металлов и некоторых экспериментально обоснованных закономерностей.
Для катодных процессов существуют следующие закономерности:
1. Катионы металлов, стандартные электродные потенциалы которых выше, чем у водорода, т.е. расположенные в этом ряду правее его (Cu, Hg, Ag, Pt, Au), при электролизе полностью восстанавливаются на катоде в виде металла: Men+ + nе– → Me0.
2. Катионы металлов с малой величиной стандартного электродного потенциала (Li+, Na+, K+, Rb+, …, до Al3+ включительно) при электролизе на катоде не восстанавливаются, а вместо них восстанавливаются молекулы воды: 2H2O + 2e– → Н2 + 2ОН–.
3. Катионы металлов со стандартными электродными потенциалами меньше, чем у водорода, но больше, чем у алюминия (Mn2+, Zn2+, Cr3+, Fe2+, …, до H), при электролизе восстанавливаются на катоде одновременно с молекулами воды, т.е. одновременно идут два процесса:
При электролизе водных растворов кислот и щелочей на катоде всегда выделяется водород.
Для анодных процессов:
1. При электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, в которых атомы неметаллов или металлов находятся в высшей степени окисления (NO3–, SO42–, PO43–, ClO4–, MnO4– и т.п.), а также фторид-ионов F– на аноде будут окисляться не анионы, а гидроксид-ионы и молекулы воды и выделяться кислород:
2. При электролизе хлоридов, бромидов, йодидов у анода будут разряжаться анионы и выделяться соответствующие галогены:
3. При электролизе анионов, содержащих неметалл в промежуточной степени окисления (SO32–, NO2– и др.), они сами окисляются на аноде:
Усвоение учебного материала по данной теме на ЕГЭ проводят с помощью заданий повышенного уровня сложности.
Пример 1. Установите соответствие между формулой вещества и продуктами, которые могут образовываться на катоде в результате электролиза его водного раствора.
Нитрат меди (II). Медь в электрохимическом ряду напряжений металлов стоит после водорода. Следовательно, при электролизе она выделится на катоде в виде металла: Cu2+ + 2е– → Cu0. На аноде при этом будет происходить окисление молекул воды и выделяться кислород: 2H2O – 4e– → О2 + 4Н+. Уравниваем процессы окисления и восстановления:
Окончательно получаем:
Нитрат серебра. Серебро в электрохимическом ряду напряжений металлов стоит после водорода. Следовательно, при электролизе оно выделится на катоде в виде металла: Ag+ + 1е– → Ag0. На аноде при этом будет происходить окисление молекул воды и выделяться кислород: 2H2O – 4e– → О2 + 4Н+. Уравниваем процессы окисления и восстановления:
Окончательно получаем:
Хлорид железа (II), FeCl2. Железо в ряду напряжений стоит после алюминия и до водорода. При электролизе на катоде восстанавливаются и металл, и молекулы воды, т. е. одновременно идут два процесса: Fe2+ + 2е– → Fe0; 2H2O + 2e– → Н2 + 2ОН–. На аноде будет выделяться хлор: 2Cl– – 2e– → Cl20.
Уравниваем процессы окисления и восстановления:
Окончательно получаем:
Сульфат калия. Катион калия в ряду напряжений металлов стоит до алюминия. Поэтому катион калия при электролизе на катоде не восстанавливается, а вместо него восстанавливаются молекулы воды: 2H2O + 2e– → Н2 + 2ОН–. На аноде будут окисляться молекулы воды: 2H2O – 4e– → О2 + 4Н+.
Уравниваем процессы окисления и восстановления:
После сокращения получаем:
Ответ: А – 1; Б – 5; В – 6; Г – 2.