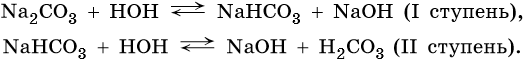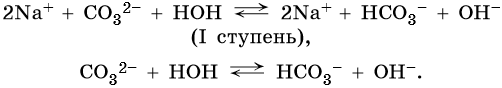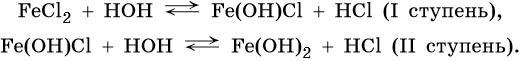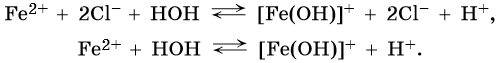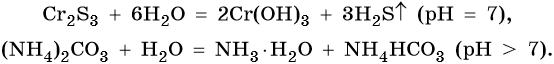Гидролиз солей

Гидролизом называют взаимодействие ионов соли с водой, которое приводит к образованию слабого электролита. По отношению к гидролизу различают четыре типа солей.
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются.
Соли, образованные сильным основанием и слабой кислотой, гидролизуются по аниону. Среда таких растворов щелочная (pH > 7), например:
или в ионной форме
Гидролиз по второй ступени практически не протекает.
Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Среда таких растворов кислая (pH < 7,0), например:
Гидролиз по второй ступени практически не идет.
Уравнение гидролиза по I ступени в ионной форме:
Соли, образованные слабым основанием и слабой кислотой, гидролизуются по катиону и аниону. Такие реакции часто идут полностью и до конца, гидролиз необратим. Реакция и pH среды растворов таких солей зависят от относительной силы кислот и оснований, например:
Гидролиз солей подчиняется принципу Ле Шателье и зависит от концентрации и температуры. При разбавлении растворов гидролиз усиливается, а при концентрировании замедляется. С повышением температуры резко возрастает концентрация ионов H+ и OH–, поэтому гидролиз протекает полнее.
Гидролиз кислых солей имеет свои особенности. В этом случае наряду с гидролизом происходит диссоциация аниона кислой соли, поэтому реакция раствора может быть как щелочной (если гидролиз аниона преобладает над его диссоциацией), так и кислой (в обратном случае). Запомним некоторые примеры: Na2CO3 и NaHCO3 — щелочная; Na2SO3 — щелочная, а NaHSO3 — кислая; Na3PO4, Na2HPO4 — щелочная, а NaH2PO4 — кислая.
Перечислим еще ряд солей, определение реакции среды водных растворов которых вызывает затруднения у учащихся. AgNO3, CaCl2 — нейтральная, NaF, (NH4)2CO3 — слабощелочная, NH4F, MgCl2, Mg(NO3)2 — слабокислая. NH4NO2 — гидролиз по катиону и аниону.
Рассмотрим типовой пример задания.
Пример. Установите соответствие между названием соли и ее способностью к гидролизу.
Ацетат калия — соль, образованная анионом слабой уксусной кислоты и катионом сильного основания — гидроксида калия, следовательно, она гидролизуется по аниону. Сульфид калия также образован анионом слабой кислоты (H2S) и катионом сильного основания (KOH). Гидролиз по аниону. Хлорид железа (II) образован анионом сильной кислоты (HCl) и катионом слабого основания Fe(OH)2. Гидролиз по катиону. Сульфид хрома (III) образован катионом слабого основания Cr(OH)3 и анионом слабой кислоты Н2S, поэтому подвергается гидролизу по катиону и аниону.
Ответ: А – 3; Б – 3; В – 2; Г – 4;