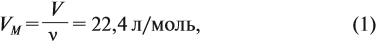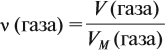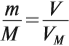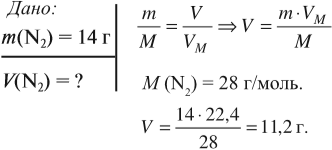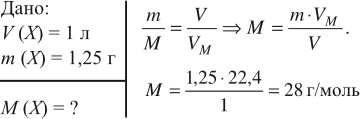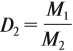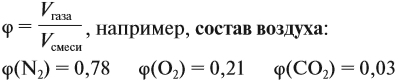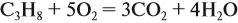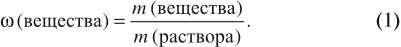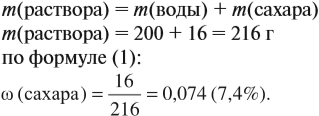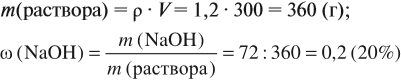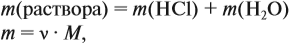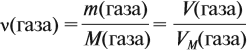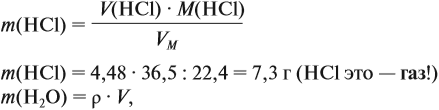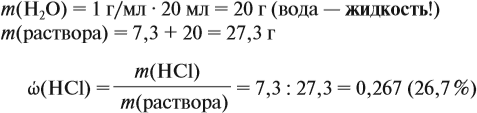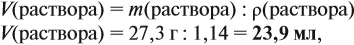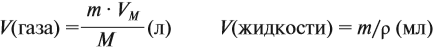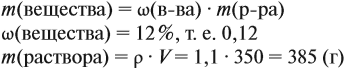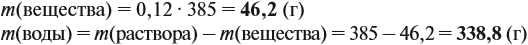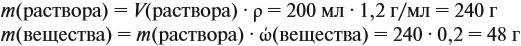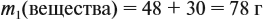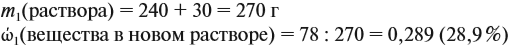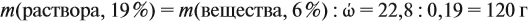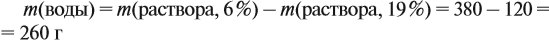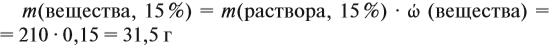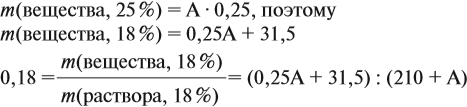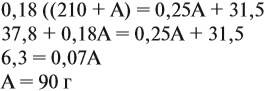Урок 30. Задачи, решаемые по стандартным формулам

В ходе решения таких задач рекомендуется придерживаться алгоритма:
- внимательно прочитать условие задачи и выяснить, что у вас спрашивают;
- написать соответствующую формулу и проанализировать её;
- найти числовые значения требуемых величин, каждый раз записывая вначале формулу, а затем расчёт, учитывая размерность величин.
Содержание
Задачи по теме «Газы»
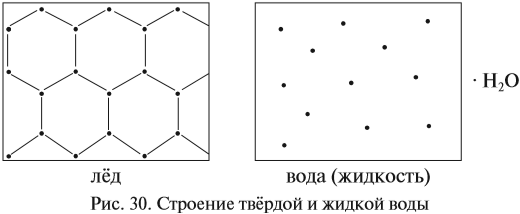
Известно, что вещества при нормальных условиях (н. у.) могут находиться в трёх агрегатных состояниях: твёрдом, жидком, газообразном. В твёрдом и жидком состояниях между молекулами (атомами) вещества имеются довольно сильные взаимодействия, в результате чего частицы находятся на небольших расстояниях друг от друга (рис. 30).
В газах расстояния между частицами очень велики, и силы взаимодействия ничтожны (рис. 31).
Поэтому равные объёмы любых газов содержат одинаковое число молекул. Это формулировка закона АВОГАДРО.
Следствием этого закона является:
1 моль любого газа при нормальных условиях (н. у.) занимает объём 22,4 литра.
Эта величина (22,4 л/моль) является молярным объёмом газа (VМ):
где VM — молярный объём газа, моль/л; V — объём газа, л; ν — количество вещества газа, моль.
Таким образом, зная массу газа, можно определить:
Но для того же газа из формулы (1) имеем:
Отсюда для любого газа выполняется соотношение:
Задача 3. Какую массу имеет кислород объёмом 7 л?
Задача 4. Какой объём занимает азот массой 14 г?
Задача 5. Чему равна молярная масса газа, 1 л которого имеет массу 1,25 г?
Ответ. Молярная масса неизвестного газа 28 г/моль.
Пользуясь этими формулами, можно рассчитать объём, массу, молярную массу газа, например:
Известно, что
где ρ — плотность газа (г/л), поэтому:
ПОМНИТЕ! Эти формулы можно использовать лишь тогда, когда данные задачи (плотность газа, его объём) измерены при н. у.: 273 К, 1 атм.
Из формулы (3) вытекает понятие об относительной плотности газов (Dx). Эта величина, равная отношению плотностей двух газов:
где ρ1 и М1 — плотность и молярная масса одного газа, а ρ2 и М2 — плотность и молярная масса другого газа.
Относительная плотность газа показывает, во сколько раз данный газ тяжелее второго газа. Пользуясь этой формулой, можно легко определить молярную массу данного газа:
Выполняя такие расчёты, следует помнить, что:
- любая смесь газов, например воздух, именуется в задачах словом «газ»;
- средняя молярная масса воздуха, как показывают расчёты, равна 29 г/моль;
- по умолчанию, если не сказано иного, расчёты ведут для н. у.: 273 К, 1 атм.
Задача 6. Определить молярную массу газа, если:
а) плотность его равна 1,25 г/л;
б) плотность его по кислороду равна 0,75.
Решение.
Состав смеси газов, как правило, измеряют в объёмных процентах φ (фи).
Второе следствие, при помощи которого была экспериментально подтверждена гипотеза Авогадро (гипотеза стала законом уже после смерти автора!), заключается в следующем: объемы реагирующих газов относятся как их коэффициенты в соответствующем уравнении реакции.
Это следствие позволяет решать задачи «в уме», если известны объёмы реагирующих газов или количества вещества для них.
Задача 7. Какой объём кислорода потребуется для сжигания 6 л пропана?
Из уравнения реакции:
видно, что молярное соотношение пропана и кислорода составляет 1 : 5. Таким образом, объём кислорода в пять раз больше объёма пропана.
Ответ. Требуется 5 · 6 = 30 л кислорода.

Задачи для самостоятельного решения
3. Определить массы газов:
а) хлороводорода, объёмом 56 л;
б) озона О3, объёмом 14 л.
4. Определить объёмы газов:
а) хлороводорода, массой 72 г;
б) аммиака NH3, массой 3,4 г.
5. Определить молярные массы газов, если:
а) 2 л газа имеет массу 2,86 г;
б) 10 г газа занимает объём 7,47 л.
6. Определить молярную массу газа, если:
а) плотность его равна 1,52 г/л;
б) плотность по кислороду равна 1,81.
7. Какой объем занимает смесь, состоящая из 4 г метана и 22 г пропана?
8. Какой газ имеет большую массу: этан, объёмом 56 л или бутан, объёмом 44,8 л?
9. Существуют ли газообразные соединения серы легче воздуха?
10. Определите, не выполняя расчёт, какой из газов тяжелее воздуха: Не, Ar, CO2, CH4, N2, O2.
Задачи по теме «Способы выражения концентрации растворов»
Для того чтобы определить массовую долю растворенного вещества, нужно воспользоваться формулой:
Ответ может быть дан в долях (единицы): ω = 0,15; или в процентах: ω% = 15 %.
Задача 8. В 200 г воды растворили 16 г сахара. Определить ω(сахара) в полученном растворе.
Решение. В данном случае масса раствора неизвестна. Но:
Задача 9. В 300 мл раствора (ρ = 1,2 г/мл) содержится 72 г NаОН. Определить ω(NаОН) в этом растворе.
Решение. В этом случае масса раствора неизвестна, но известен объём. Найдём массу раствора:
Задача 10. В 20 мл воды растворили 4,48 л хлороводорода. Определить ω(НСl) в соляной кислоте. Плотность раствора равна 1,14 г/мл.
Решение. При растворении хлороводорода в воде получена соляная кислота, её масса равна:
где ν — количество вещества, моль; M — молярная масса вещества, причём для газов
откуда
где ρ — плотность воды (1 г/мл); V — объём воды, мл
Обратите внимание: в 20 мл воды растворили 4,48 л газа, но суммарный объём отнюдь не равен (4,48 + 0,02), т. е. 4,5 литра! Суммарный объём этого раствора равен:
т. е. при растворении более 4 литров газа объём жидкого раствора увеличился менее чем на 4 миллилитра!
Выводы.
- Объёмы жидкостей и объёмы растворяемых газов суммировать нельзя.
- При растворении в жидкости газы сжимаются более чем в 1000 раз.
- Объёмы жидкостей и газов рассчитывают (исходя из значения массы) по-разному:
где m — масса, г; М — молярная масса, г/моль; V — объём (жидкости в мл, газа — в л); ρ — плотность жидкости, г/мл.
Пользуясь формулой (1) нетрудно рассчитать и массу раствора, и массу растворённого вещества. Но при этом следует учитывать, что обычно в задачах говорится (упоминается) о «5 %-ном растворе», «16 %-ном растворе» и т. д., т. е. массовая доля вещества выражена в процентах. В этом случае легко видеть, что:
- в 5 %-ном растворе ω(вещества) = 0,05;
- в 16 %-ном растворе ω(вещества)= 0,16 и т. д.
Зная массовую долю вещества в растворе, можно определить:
Задача 11. Сколько граммов соли и воды нужно взять для приготовления 350 мл (ρ = 1,1 г/мл) 12 %-ного раствора?
Решение. Из формулы (1) получаем формулу (2):
где ρ — плотность раствора (1,1 г/мл); V — объём раствора (350 мл), тогда
Задача 12. Сколько граммов 8 %-ного раствора можно приготовить, имея 64 г NaCl?
Решение. Из формулы (3):
Такие задачи можно решать, составляя пропорции. При этом следует знать, что массовая доля (в %) вещества показывает, сколько граммов вещества содержится (растворено) в 100 граммах раствора: 5 %-ный раствор ⇒ 5 г вещества в 100 граммах раствора.
Задача 13. Сколько мл 15 %-ного раствора (ρ = 1,1 г/мл) можно приготовить из 22,5 г вещества?
Обратите внимание: в пропорции в одном столбце должны совпадать и размерность, и наименование компонента, о котором идёт речь.
Задача 14. К 200 мл 20 %-ного раствора (ρ = 1,2 г/мл) добавили 30 г того же вещества. Определить массовую долю вещества в полученном растворе.
Решение. Определим в начале массу исходного раствора и растворённого вещества:
При добавлении новых порций растворяемого вещества, его масса увеличивается:
На ту же величину увеличивается масса раствора:
Задача 15. Сколько граммов 19 %-ного раствора и воды нужно взять для получения 380 г 6 %-ного раствора?
Решение. При добавлении воды масса растворённого вещества не меняется. Поэтому рассчитаем массу растворённого вещества в 6 %-ном растворе (столько же его будет и в 19 %-ном растворе):
Теперь можно рассчитать массу 19 %-ного раствора:
Теперь задумаемся: почему возросла масса исходного 19 %-ного раствора? Потому, что добавили воду. Значит, масса воды равна:
Ответ. Нужно добавить 260 г воды.
В случаях, когда изменяется и масса раствора, и масса вещества, нужно прибегнуть к приёму, когда неизвестная величина (о ней спрашивается в вопросе задачи), принимается за известную, и обозначается А.
Задача 16. Сколько граммов 25 %-ного раствора нужно добавить к 210 г 15 %-ного раствора, чтобы получить 18 %-ный раствор?
Решение. Пусть нужно добавить А граммов 25 %-ного раствора, тогда масса 18 %-ного раствора составит (210 + А) г. Определим массу вещества в 15 %-ном растворе:
аналогично:
Решим полученное уравнение:
Ответ. Нужно добавить 90 г 25 %-ного раствора.

Задачи для самостоятельного решения
11. В 300 г раствора содержится 45 г поваренной соли. Определить ω (NaСl) в этом растворе.
12. В 300 мл воды растворили 100 г сахара. Определить ω (сахара) в полученном растворе.
13. В 2 л раствора (пл. = 1,05 г/мл) содержится 105 г соли. Определить ω(соли) в этом растворе.
14. В 200 мл воды растворили 56 л аммиака NH3. Определить ω (NH3) в этом растворе.
15. Бромоводород объёмом 5,4 л затрачен на приготовление 8 %-ного раствора (пл. = 1,057 г/мл). Найти объём полученного раствора.
16. Сколько граммов воды и сахара нужно взять для приготовления 3 литров 30 %-ного сиропа? (Пл. = 1,13 г/мл.)
17. Какой объём 25 %-ного раствора можно приготовить из 150 г соли, если плотность раствора равна 1,2 г/мл?
18. К 500 мл 32 %-ной кислоты (ρ = 1,2 г/мл) добавили 1 л воды. Вычислить массовую долю кислоты в полученном растворе.
19. Смешали 25 г 16 %-ного раствора КОН с 30 мл 20 %-ного раствора КОН (плотность 1,2 г/мл). Вычислить массовую долю щёлочи в полученном растворе.
20. К 220 г 20 %-ного раствора поваренной соли добавили 44 мл воды и 36 г этой же соли. Вычислить массовую долю соли в полученном растворе.
21. Определить массу воды, которую нужно выпарить из 1 кг 3 %-ного раствора сульфата меди II для получения 5 %-ного раствора.
22. Сколько граммов воды нужно добавить к 50 г 70 %-ной уксусной кислоты, чтобы получить 5 %-ный уксус?
23. После добавления соды к 200 мл 16 %-ного раствора её (ρ = 1,17 г/мл) массовая доля вещества возросла до 20 %. Определить массу добавленной соды.
24. Какой объём 96 %-ной кислоты (ρ = 1,86 г/мл) необходимо добавить к 5 л 30 %-ной кислоты (ρ = 1,3 г/мл), для того чтобы получить 40 %-ный раствор?