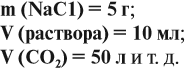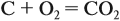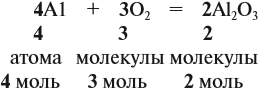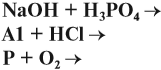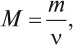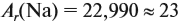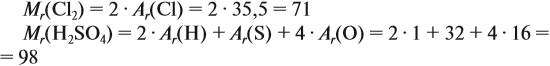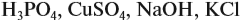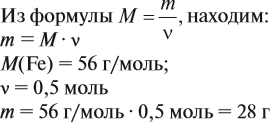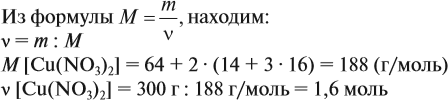Урок 29. Основные расчетные понятия

Задачи по химии являются превосходной «гимнастикой» для ума, поскольку позволяют ученику развивать логическое мышление, составлять и реализовывать план решения задачи, а параллельно повторять те или иные разделы химической науки. Все задачи, которые предлагаются для решения, можно разделить на две группы:
- задачи, которые решаются по стандартной формуле;
- задачи, которые решаются по уравнению реакции.
Многие задачи содержат и то и другое. Поэтому сначала нужно изучить уроки 29, 30, 31, а затем переходить к решению более сложных заданий.
В начале каждого урока рассматривается, КАК решать задачи, и рассматривается подробно ход решения её и образец оформления решения. Такие задачи обозначены как Задача 1, далее идёт сквозная нумерация их: всего задач 35.
В конце каждого урока даны задачи для самостоятельного решения, для них также предусмотрена сквозная нумерация: всего задач 97. Почти все эти задачи «распределены» по урокам Самоучителя так, чтобы, изучая какую-либо тему, вы могли бы закрепить материал, решая задачи и выполняя упражнения. В случае затруднений найдите эту задачу среди задач для самостоятельного решения, а потом посмотрите, как решаются такие задачи.
Рассмотрим сначала основные расчётные понятия.
Как известно, количества реагирующих простых и сложных веществ и смесей обычно измеряют в граммах, литрах, миллилитрах. Данные в этих случаях записывают так:
Однако при расчётах по уравнениям реакций этих расчётных понятий оказывается недостаточно. Дело в том, что в каждой химической реакции участвуют определённые частицы (атомы, молекулы, ионы), масса которых, естественно, различна. И поэтому даже для простейших химических реакций типа:
нельзя утверждать, что 1 г углерода полностью прореагирует с 1 г кислорода. Посмотрите в таблицу Менделеева: атомные массы этих химических элементов разные! Каким же образом выполняется расчёт по химическим уравнениям?
Поскольку в химических реакциях участвуют частицы (молекулы, атомы, ионы), то основным расчётным понятием является моль — величина, при помощи которой можно определить число частиц.
1 моль любого вещества содержит 6 · 1023 частиц (молекул, атомов, ионов).
Например:
- 1 моль Аl содержит 6 · 1023 атомов алюминия;
- 1 моль НСl содержит 6 · 1023 молекул хлороводорода.
Число молей (ν) реагирующих веществ определяют по коэффициентам в уравнении химической реакции:
Задание 29.1. Расставьте коэффициенты и подпишите под химическими формулами число молей реагирующих веществ:
Каким образом можно определить массу или объём реагирующих веществ, зная их количества (в молях)?
Для определения массы используют величину «молярная масса»:
где М — молярная масса, г/моль; m — масса, г; ν — количество вещества, моль*.
* ν — греческая буква «ню», которую не следует путать с латинской v.
Молярная масса равна массе вещества количеством 1 моль.
То есть молярная масса это масса всех 6 · 1023 молекул (атомов, ионов). Молярная масса (М) совпадает по величине с относительной атомной (Аr) или молекулярной (Мr) массой вещества, которые легко определяются по таблице Менделеева.
Так, относительная атомная масса (Аr) химического элемента указана в таблице Менделеева:
Это безразмерная величина.
Задание 29.2. Определите по таблице Менделеева:
Относительная молекулярная масса (Мr) вещества равна сумме относительных атомных масс атомов всех элементов, входящих в состав этого вещества. При подсчёте значения относительных атомных масс их рекомендуется округлять (обычно до целых чисел):
Это безразмерные величины.
Задание 29.3. Рассчитайте относительные молекулярные массы веществ:
Теперь несложно определить массы реагирующих веществ.
Задача 1. Определить массу железа количеством 0,5 моль.
Решение.
Задача 2. Определить количество вещества Сu(NO3)2 массой 300 г.
Решение.

Задачи для самостоятельного решения
1. Определить массу:
а) алюминия, количеством 0,1 моль;
б) серной кислоты, количеством 1,5 моль;
в) сульфата алюминия, количеством 0,2 моль.
2. Определить количество вещества (моль):
а) магния, массой 4,8 г;
б) азотной кислоты, массой 126 г;
в) нитрата аммония, массой 40 г.