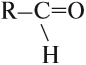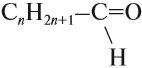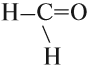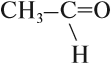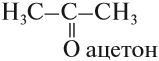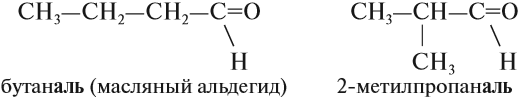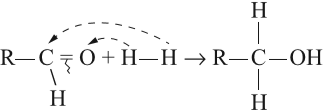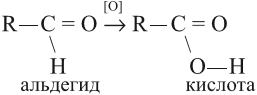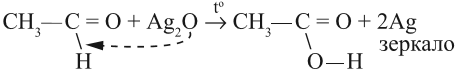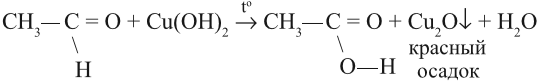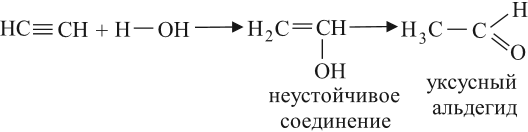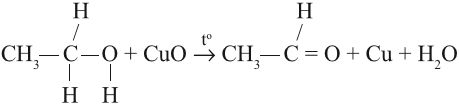Урок 23. Альдегиды

Содержание
Определение. Гомологический ряд, номенклатура, изомерия
Альдегиды — это производные углеводородов, которые содержат альдегидную группу:
Альдегидная группа состоит из карбонильной группы С=О, соединённой с атомом водорода. Карбонильная группа в молекулах альдегидов всегда находится на конце углеродной цепи.
Предельные альдегиды образуют гомологический ряд с общей формулой:
Если использовать эту общую формулу, то следует помнить, что минимальное значение n (числа атомов углерода) равно нулю.
Если n = 0 получаем
метанАЛЬ, муравьиный альдегид, формальдегид;
Если n = 1 получаем
этанАЛЬ, уксусный альдегид, ацетальдегид.
Вопрос. Какой суффикс обозначает наличие в молекуле альдегидной группы?
Названия альдегидов составляют, добавляя суффикс АЛЬ к названию соответствующего углеводорода. При этом учитываются все атомы углерода. Кроме того, используются тривиальные названия, которые совпадают с названиями соответствующих кислот (см. урок 24.1). И, наконец, для некоторых альдегидов используют названия, имеющие латинский корень, например формальдегид — от лат. formika — «муравей».
Задание 23.1. Составьте формулу и название альдегида с n = 3. Имеет ли он изомеры?
Начиная с n = 3 у альдегидов появляются изомеры положения карбонильной группы:
Задание 23.2. Допишите атомы водорода к этим цепочкам и убедитесь, что это — изомеры. Является ли вещество (2) альдегидом?
Но при перемещении карбонильной группы в середину молекулы исчезает альдегидная группа: вещество (2) не альдегид, это — кетон:
По номенклатуре ИЮПАК кетоны называют, добавляя суффикс ОН к названию соответствующего углеводорода.
Задание 23.3. Составьте формулы и названия альдегидов с n = 4. Дайте им названия.
Изомерия альдегидов связана со строением углеводородного радикала:

Строение молекул
Отличительным признаком альдегидов является наличие в их молекуле альдегидной группы. В её состав входят атомы углерода и кислорода, связанные двойной связью.
Вопрос. Какой тип реакций характерен для соединений с двойной связью?
Поэтому альдегиды легко вступают в реакции присоединения по месту разрыва π-связи карбонильной группы.
Кроме того, в состав альдегидной группы входит атом водорода, соединённый с карбонильной группой.
Вопрос. Является ли эта связь полярной?
За счёт разрыва полярной С–Н связи альдегидной группы альдегиды очень легко окисляются. Атом кислорода альдегидной группы делает эту группу в целом сильно полярной. Поэтому альдегидная группа влияет на углеводородный радикал, и в радикале возможны реакции замещения.

Свойства альдегидов
Физические свойства
В альдегидах отсутствует гидроксогруппа, за счёт которой между молекулами спиртов возникали водородные связи.
Вопрос. Какие соединения (спирты или альдегиды) имеют бОльшую температуру кипения?
Поэтому альдегиды, в отличие от спиртов, легче испаряются, имеют меньшие температуры кипения. Например, формальдегид — газ с резким запахом, а метанол — жидкость. Низшие альдегиды могут растворяться в воде. Раствор формальдегида в воде (формалин) применяется в медицине, кожевенной промышленности. Его применение основано на том, что формальдегид активно реагирует с белками, вызывая в них необратимые изменения (денатурацию). Следовательно, формальдегид сильно ядовит.
Химические свойства
При рассмотрении строения молекулы альдегидов были сделаны выводы, что для них должны быть характерны реакции присоединения, замещения (в углеводородном радикале), и окисления.
Примером реакции присоединения к карбонильной группе может служить реакция гидрирования, т. е. присоединения водорода:
Вопрос. К какому классу относится полученное соединение? Назовите его.
При окислении альдегидов образуются кислоты:
Окисление альдегидов происходит даже при их хранении, т. е. в обычных условиях. Реакции окисления альдегидов используют для того, чтобы обнаружить их в растворах. Например, если к раствору альдегида добавить аммиачный раствор оксида серебра и нагреть, то на стенках сосуда появится зеркало. Это выделилось чистое серебро, которое блестящим тонким слоем покрыло стекло:
Эта реакция получила название «реакция серебряного зеркала».
Альдегид можно превратить в кислоту (окислить) и при помощи гидроксида меди (II). Если к осадку Сu(ОН)2 добавить раствор альдегида и нагреть, то образуется жёлтый осадок СuОН, переходящий в красный оксид меди (I). В результате образуется оранжевый осадок:
Если эту же смесь долго греть, то на стенках пробирки выделится в виде блестящего слоя чистая медь «медное зеркало». Поэтому эту реакцию часто называют реакцией «медного зеркала».
Запомните: реакции «серебряного зеркала» и «медного зеркала» — качественные реакции на альдегидную группу.
Задание 23.4. Составьте уравнения качественных реакций для формальдегида.
Вопрос. Можно ли при помощи гидроксида меди (II) различить растворы глицерина и уксусного альдегида? Укажите условия и эффекты обеих реакций.

Получение и применение альдегидов на примере уксусного альдегида
Уксусный альдегид получают в больших количествах при помощи реакции Кучерова*:
* Кучеров Михаил Григорьевич (3.06.1850–26.06.1911) — русский химик-органик, открыл (1881) реакцию каталитической гидратации ацетиленовых углеводородов с образованием карбонилсодержащих соединений.
В небольших количествах этот альдегид можно получить окислением этанола:
Задание 23.5. В уроках 20.3 и 22.4 посмотрите на соответствующие уравнения реакций; обратите внимание, за счёт каких атомов они происходят, и попробуйте составить аналогичные уравнения реакций:
- пропин + вода →
- пропанол-1 + СuО →
- пропанол-2 + СuО →
Сделайте вывод: всегда ли в этих реакциях получаются альдегиды?
Если Вы всё сделали правильно, в реакциях 1 и 3 получается ацетон (кетон), а в реакции 2 — пропаналь.
Уксусный альдегид применяют для получения уксусной кислоты, этилового спирта, лекарств и других веществ.

Выводы
Альдегиды — это производные углеводородов, содержащие альдегидную группу. Для них должны быть характерны реакции
- присоединения (за счёт карбонильной группы);
- замещения (в углеводородном радикале);
- окисления.