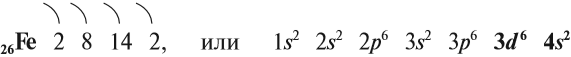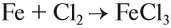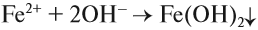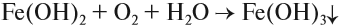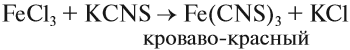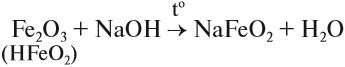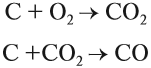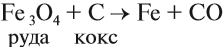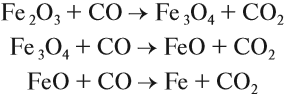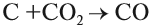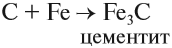Урок 11. Железо

Свойства железа и его соединений
Железо — химический элемент восьмой группы, четвёртого периода, следовательно, строение его атома можно изобразить схемой:
Железо — очень распространённый элемент периодической системы. Среди химических элементов, которые входят в состав Земной коры, оно занимает четвёртое место. В центре Земли имеется массивное железно-никелевое ядро, которое обеспечивает естественный магнетизм Земли.
Хотя атом железа в соединениях может проявлять степени окисления +2, +3, +6, в природе встречаются соединения преимущественно трёхвалентного железа:
- Fe2O3 — гематит (красный железняк);
- Fe2O3 · FeO — магнитный железняк;
- Fe2O3 · Н2О — бурый железняк.
Все эти руды имеют буро-красную окраску. Интересно, что от этой окраски произошло слово руда: «рудый» означает «рыжий». Дело в том, что железные руды встретились человеку давным-давно, и с освоения этих руд началась наша цивилизация, поскольку для разработки технологии выплавки железа из руды потребовались значительные интеллектуальные усилия, все знания, которых накопил человек.
Атомы железа (II) входят в состав гемоглобина крови. Именно эти атомы связывают кислород и транспортируют его по всем клеткам нашего организма. При этом атом железа становится трёхвалентным, с характерной для этого состояния «кровавой» окраской. Кстати, название руды «гематит» и означает «кровавый».
Железо — серебристо-белый пластичный металл. Это металл средней активности, тем не менее оно может реагировать с активными неметаллами (галогены, кислород, сера, углерод), кислотами, а при особых условиях — с водой. При этом если реакция происходит с сильным окислителем, то образуется соединение трёхвалентного железа. Впрочем, если в результате реакции образуется соединение двухвалентного железа, то на воздухе это соединение быстро окисляется до трёхвалентного состояния. Например, с сильным окислителем хлором образуется хлорид Fe (III):
А при взаимодействии с соляной кислотой, атом хлора которой может проявлять только восстановительные свойства, образуется хлорид железа (II).
Задание 11.1. Составить уравнение реакции взаимодействия железа с серой, водой, соляной кислотой, разбавленной азотной кислотой.
Соли железа (II) и (III) имеют разную окраску: растворы соединений железа (II) бесцветные, а растворы железа (III) — окрашены в жёлтый цвет.
При взаимодействии с щелочами из растворов солей железа можно получить его гидроксиды. Они так сильно отличаются друг от друга по цвету, что эту реакцию можно считать качественной на соединения железа с разной степенью окисления. Так, из солей Fe (II) выделяется белый (в инертной атмосфере) осадок, который на воздухе мгновенно зеленеет:
На воздухе этот осадок «ржавеет», становится буро-оранжевым. Состав полученного осадка очень близок к составу ржавчины:
Наиболее чувствительной качественной реакцией на Fe3+ является реакция с роданидом калия:
Оксид и гидроксид железа (II) проявляют основные свойства, т. е. реагируют с кислотами, но не реагируют со щелочами. В отличие от них, оксид и гидроксид железа (III) проявляют слабые амфотерные свойства. Это означает, что при обычных условиях эти вещества реагируют с кислотами и не реагируют со щелочами, но при сплавлении они со щелочами реагируют:
Кроме того, они растворяются в горячих, концентрированных растворах щелочей.
Таким образом, на примере свойств соединений железа ещё раз убеждаемся в справедливости закономерности: при возрастании степени окисления атома металла усиливаются и кислотные, и окислительные свойства соединений.
Действительно, для соединений двухвалентного железа характерны восстановительные свойства: они окисляются просто на воздухе. Для соединений трёхвалентного железа характерны окислительные свойства, они могут находиться в растворе длительное время. Единственное, что «угрожает» солям трёхвалентного железа, — гидролиз, поскольку эти соли соответствуют более слабому основанию.
Задание 11.2. Составьте уравнение реакции гидролиза хлорида железа (III).

Получение железа (чугуна и стали)
Производство чугуна основано на восстановительных свойствах углерода. Чугун образуется в домнах, куда загружают смесь кокса и железной руды. В результате горения кокса образуется необходимое для реакции тепло и сильный восстановитель — угарный газ:
Впрочем, и кокс является прекрасным восстановителем:
Угарный газ является основным восстановителем доменного процесса, поскольку ввиду газообразного состояния имеет высокую реакционную способность, способен проникать в любую точку домны. Кроме того, он не образует цементита. Эти реакции восстановления происходят при температуре 450…700 °C:
Полученный углекислый газ, реагируя с избытком кокса, вновь превращается в угарный газ:
и процесс продолжается. Он происходит в верхней части домны. Выделяющееся в твёрдом виде железо опускается в нижнюю часть домны, контактирует с коксом, начинает плавиться, так как температура в этой части печи превышает 1300 °C. Кокс, образуя сплав с железом (чугун), понижает температуру плавления железа на 400°; одновременно с этим часть железа образует цементит:
Для предохранения расплавленного железа от окисления в исходную смесь добавляют флюсы. Это известняк, который является поставщиком углекислого газа и, всплывая на поверхность, образует защитную плёнку.
Полученный чугун содержит до 4,5 % углерода, он используется для получения стали. Цель переработки — удаление примесей углерода, фосфора, серы. Готовая сталь должна содержать 0,3…2 % углерода. Кроме того, в сталь вводят различные добавки, которые изменяют её свойства. Так, нержавеющая сталь содержит около 12 % хрома.
Сталь является основным сплавом машиностроения, но легко ржавеет, так как подвергается коррозии (см. урок 8.4).

Выводы
Железо — главный металл нашей цивилизации. Станки, различные машины и механизмы, строительные конструкции, мосты, трубы — всё состоит из железа, точнее, стали или чугуна. Это достаточно активный металл, поэтому легко образует различные соединения, в которых чаще всего проявляет валентность III. Такие соединения имеют обычно красно-коричневую окраску (ржавчина).