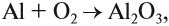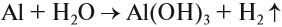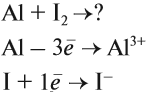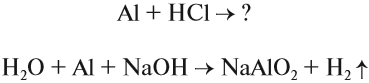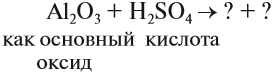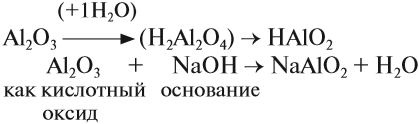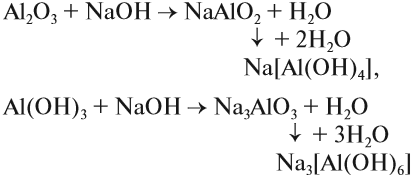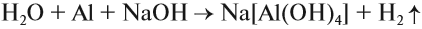Урок 10. Алюминий

Алюминий — химический элемент третьей группы, третьего периода, следовательно, строение его атома можно изобразить схемой:
Имея на внешнем уровне атома три валентных электрона, алюминий проявляет постоянную валентность III.
Алюминий — мягкий, лёгкий металл. Очень пластичный: вытягивается в тончайшую проволоку, прокатывается в фольгу толщиной всего 0,005 мм. В такую фольгу упаковывают шоколад. Сплавы алюминия с другими металлами имеют высокую прочность, сравнимую со сталью (например, дуралюмин), в то же время они существенно легче. Из таких сплавов делают самолёты, поэтому алюминий называют «крылатым металлом».
Алюминий — очень активный металл, он мгновенно окисляется на воздухе:
причем оксидная плёнка покрывает его поверхность тончайшим слоем. Прочная оксидная плёнка предохраняет алюминий от коррозии, например, алюминиевые предметы не взаимодействуют с водой. Но, если разрушить оксидную плёнку, алюминий активно реагирует с водой, даже при нормальных условиях:
Алюминий активно реагирует с неметаллами:
Вопрос. Почему атом йода принял только один электрон?
Задание 10.1. Составьте уравнения реакций алюминия с серой, азотом (N2).
Алюминий может вытеснять некоторые металлы из их оксидов:
Этот процесс называется «алюминотермия» и применяется для получения некоторых металлов из их оксидов. В результате этого процесса выделяется значительное количество теплоты, так что металл получается в расплавленном состоянии. Поэтому алюминотермия используется для сварки некоторых металлов.
Особенность алюминия заключается в том, что он может реагировать и с кислотами, и со щелочами, т. е. проявляет амфотерные свойства:
В последней реакции получилась соль метаалюминиевой кислоты, которая в свободном состоянии не выделена.
Задание 10.2. Расставьте коэффициенты в последнем уравнении реакции, пользуясь методом электронного баланса.
Такие же амфотерные свойства проявляют и оксид алюминия, и гидроксид алюминия. Другими словами, оксид алюминия реагирует и с кислотами, и со щелочами. Поскольку в химических реакциях особенно легко реагируют вещества с противоположными свойствами, при взаимодействии с кислотами оксид алюминия ведет себя как обычный основный оксид.
Задание 10.3. Составьте уравнение реакции оксида алюминия с серной кислотой.
При взаимодействии со щелочами оксид алюминия ведет себя как кислотный оксид. А в этом случае, необходимо выяснить, какая кислота соответствует данному оксиду.
Вспомните или см. урок 2.1:
Вопрос. Можно ли в алюминиевой посуде длительное время хранить кислые щи? Щелочные растворы?
Такие же амфотерные свойства проявляет и гидроксид алюминия, т. е. он растворяется и в кислотах, и в щелочах:
Обратите внимание: поскольку здесь гидроксид алюминия реагирует со щёлочью (основанием), он проявляет свойства кислоты и мы формально записываем его состав в «кислотном» виде, т. е. атомы водорода записываются впереди.
Задание 10.4. Составьте уравнения реакций гидроксида алюминия с серной кислотой и гидроксидом кальция. Запишите оба уравнения в ионном виде.
Очень важно понимать, что осадок гидроксида алюминия растворяется в избытке щелочи. Поэтому при получении осадка гидроксида алюминия нужно к щёлочи прибавлять избыток растворимой соли алюминия. Если действовать наоборот, то лишняя щёлочь тут же растворит гидроксид алюминия и осадок не получится. Растворение осадка гидроксида алюминия в избытке щёлочи является качественным признаком присутствия солей алюминия в данном растворе.
Необходимо отметить, что все вышеприведенные реакции взаимодействия алюминия и его соединений со щелочами происходят при сплавлении (без воды). В растворах щелочей происходит растворение этих веществ, что приводит к образованию комплексных соединений:
При этом атом алюминия входит в состав прочного комплексного иона, который практически не диссоциирует.
Поэтому растворение алюминия* в растворе щёлочи можно выразить уравнением:
* Аналогичными амфотерными свойствами обладают цинк и его соединения.
Задание 10.5. Расставьте коэффициенты в последнем уравнении реакции, пользуясь методом электронного баланса.
Аналогичными свойствами обладает цинк, его оксид и гидроксид.
Алюминий занимает третье место (после кислорода и кремния) по распространённости на нашей планете и первое место среди металлов. Он входит в состав гранита, глины, драгоценных камней (основу сапфира, аметиста, рубина составляет оксид алюминия). Практическое применение находит как сам алюминий, так и его сплавы, а также некоторые его соли. Так, сульфат алюминия применяется для очистки питьевой воды.
Вопрос. Какие сплавы алюминия вам известны? Где они применяются? (См. урок 8.2.)

Выводы
Алюминий — амфотерный металл, причем некоторые его соединения (оксид, гидроксид) также амфотерны. Поскольку посуда из алюминия встречается на каждой кухне, эти свойства алюминия должен знать каждый и помнить: в алюминиевой посуде кислые и солёные продукты, щелочные растворы хранить нельзя!