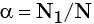Электролиты и неэлектролиты

Электролитами называют вещества, водные растворы или расплавы которых проводят электрический ток. Электролитической диссоциацией называют распад электролитов в растворах или расплавах на ионы.
Степенью диссоциации называют отношение числа распавшихся на ионы молекул N1 к общему числу растворенных молекул N. Её обозначают символом α, определяют экспериментально и выражают в долях единицы или в процентах:
Степень диссоциации электролитов в общем случае зависит от природы электролита и растворителя, от концентрации и температуры раствора. С понижением концентрации уменьшается взаимодействие ионов в растворе, приводящее к образованию молекул, и степень диссоциации возрастает. Как правило, степень диссоциации возрастает при повышении температуры.
По степени диссоциации электролиты делят на сильные, слабые и электролиты средней силы.
К сильным электролитам относят вещества, которые практически полностью диссоциируют на ионы: HCl, HNO3, H2SO4, HI, KOH, NaOH и многие растворимые в воде соли (NaCl, K2SO4). Степень диссоциации таких электролитов > 0,3.
К слабым электролитам относят вещества, диссоциирующие на ионы в незначительной степени, например H3BO3, CH3COOH, HCN, H2S. Степень диссоциации таких электролитов < 0,03.
К электролитам средней силы относят вещества, в растворах которых число диссоциирующих молекул примерно равно числу молекул, не подвергшихся диссоциации, например: H2SO3, HNO2, H3PO4 и т. д. Их степень диссоциации лежит в пределах от 0,03 до 0,3.
Данная классификация весьма условна и относится к растворам электролитов с концентрацией 5—10%. Следует подчеркнуть, что в бесконечно разбавленных растворах степень диссоциации любого (даже слабого!) электролита близка к 1.