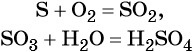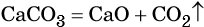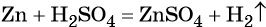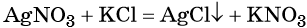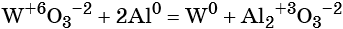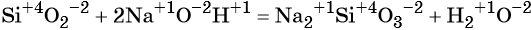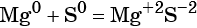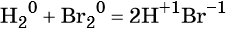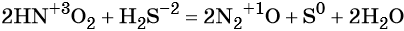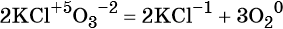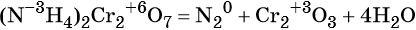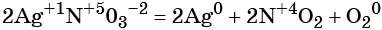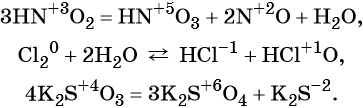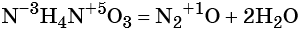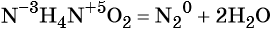Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии

Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков.
По числу и составу исходных и полученных веществ различают реакции соединения, разложения, обмена и замещения.
Реакциями соединения называют химические реакции, в результате которых сложные молекулы получаются из двух и более простых, например:
Реакциями разложения называют химические реакции, в результате которых простые молекулы получаются из более сложных, например:
Реакциями замещения называют химические реакции, в результате которых атом или группа атомов в молекуле вещества замещается на другой атом или группу атомов, например:
Реакциями обмена называют химические реакции, протекающие без изменения степеней окисления элементов и приводящие к обмену составных частей реагентов, например:
По изменению степеней окисления химических элементов, входящих в состав реагирующих веществ, реакции делят на окислительно-восстановительные и не окислительно-восстановительные.
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов:
Не окислительно-восстановительными называют реакции, в которых степень окисления химических элементов, входящих в состав реагентов, не изменяется.
Окислительно-восстановительные реакции разделяют на следующие основные типы: реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Реакциями межмолекулярного окисления-восстановления называют реакции, в которых обмен электронами происходит между различными атомами, молекулами или ионами, например:
(сера — окислитель, магний — восстановитель).
(бром — окислитель, водород — восстановитель).
(окислитель — азотистая кислота, восстановитель — сероводород).
Таким образом, атом-окислитель и атом-восстановитель в данных реакциях принадлежат разным веществам.
Реакциями внутримолекулярного окисления-восстановления называют реакции, в которых атом-окислитель и атом-восстановитель входят в состав одной и той же молекулы.
(окислитель — атом хлора в степени окисления +5, восстановитель — атом кислорода в степени окисления –2).
(окислитель — атом хрома в степени окисления +6, восстановитель — атом азота в степени окисления –3).
(окислители — атомы серебра в степени окисления +1 и азота в степени окисления +5, восстановитель — атом кислорода в степени окисления –2).
Реакциями диспропорционирования называют реакции, в которых молекулы или ионы одного и того же вещества реагируют друг с другом как окислитель и восстановитель. При этом содержащиеся в данном соединении атомы с переменной промежуточной степенью окисления переходят один в высшую, другой — в низшую степень окисления, например:
Реакциями конмутации называют реакции окисления-восстановления, в результате которых происходит выравнивание степеней окисления атомов одного и того же элемента, например:
(окислитель — атом азота в степени окисления +5, восстановитель — атом азота в степени окислителя –3).
(окислитель — атом азота в степени окисления +3, восстановитель — атом азота в степени окислителя –3).
По тепловому эффекту, сопровождающему химические реакции, их разделяют на экзотермические и эндотермические.
Экзотермическими называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH < 0.
Эндотермическими называют химические реакции, идущие с поглощением теплоты. Для эндотермических реакций Q < 0, а ΔH > 0.
В соответствии с агрегатным состоянием реагентов различают гомогенные и гетерогенные химические реакции.
Гомогенными называют реакции, протекающие в однородной среде.
Гетерогенными называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например твёрдой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
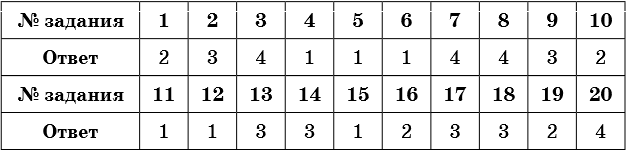
Тренировочные задания
1. Реакция 3CaО + P2O5 = Ca3(PO4)2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
2. Реакция Na2SO4 + Ba(OH)2 = BaSO4 + 2NaOH относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
3. Реакция H2SO4 + Fe = FeSO4 + H2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
4. Реакция CaCO3 = CaO + CO2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
5. Реакция разложения описана уравнением
1) Cu(OH)2 = CuO + H2O
2) BaO + H2O = Ba(OH)2
3) Na2SO4 + BaCl2 = ZnCl2 + BaSO4
4) FeO + H2 = Fe + H2O
6. Реакция соединения описана уравнением
1) Br2 + H2 = 2HBr
2) H2SO4+ 2NaOH = Na2SO4 + 2H2O
3) ZnS + 2HCl = ZnCl2 + H2S
4) HI + NaOH = NaI + H2O
7. К каталитическим процессам относят реакцию между
1) калием и водой
2) серой и хлором
3) азотом и литием
4) азотом и водородом
8. К экзотермическим реакциям относится взаимодействие
1) азота с кислородом
2) углерода с углекислым газом
3) воды с углеродом
4) углерода с кислородом
9. К окислительно-восстановительным реакциям не относится взаимодействие
1) натрия и хлора
2) брома и водорода
3) гидроксида калия и уксусной кислоты
4) кальция и уксусной кислоты
10. К реакциям замещения относится взаимодействие
1) серной кислоты и гидроксида натрия
2) серной кислоты и железа
3) серной кислоты и оксида натрия
4) серной кислоты и хлорида бария
11. К экзотермическим реакциям относится
1) взаимодействие соляной кислоты и гидроксида калия
2) взаимодействие азота и кислорода
3) гидролиз сульфата меди
4) разложение карбоната натрия
12. К эндотермическим реакциям относится
1) взаимодействие азота и кислорода
2) взаимодействие азотной кислоты и гидроксида лития
3) взаимодействие кислорода и водорода
4) взаимодействие воды и оксида калия
13. К окислительно-восстановительным реакциям не относится взаимодействие
1) натрия и брома
2) натрия и кислорода
3) оксида калия и воды
4) натрия и уксусной кислоты
14. Взаимодействие брома с гидроксидом калия относится к реакциям
1) нейтрализации
2) межмолекулярного окисления-восстановления
3) диспропорционирования
4) обмена
15. Взаимодействие азота и кислорода относится к реакциям
1) соединения, эндотермическим
2) соединения, экзотермическим
3) разложения, эндотермическим
4) обмена, экзотермическим
16. К эндотермическим реакциям относится взаимодействие
1) азота и лития
2) азота и кислорода
3) кислорода и кальция
4) углерода и кислорода
17. Взаимодействие оксида кальция и воды относится к реакциям
1) каталитическим, экзотермическим
2) разложения, эндотермическим
3) соединения, экзотермическим
4) обмена, эндотермическим
18. К каталитическим экзотермическим реакциям относится
1) получение фосфорной кислоты из оксида фосфора (V) и воды
2) разложение карбоната кальция
3) синтез аммиака из простых веществ
4) получение соляной кислоты из хлора и водорода
19. При нагревании нитрата серебра происходит реакция
1) соединения
2) разложения
3) замещения
4) обмена
20. Реакция, протекающая по схеме: CaCO3 = CaO + CO2 − Q, является реакцией
1) экзотермического разложения
2) разложения
3) замещения
4) эндотермического разложения