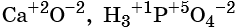Валентность химических элементов. Степень окисления химических элементов

Валентность является сложным понятием. Этот термин претерпел значительную трансформацию одновременно с развитием теории химической связи. Первоначально валентностью называли способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи.
Количественной мерой валентности атома элемента считали число атомов водорода или кислорода (данные элементы считали соответственно одно- и двухвалентными), которые элемент присоединяет, образуя гидрид формулы ЭHx или оксид формулы ЭnOm.
Так, валентность атома азота в молекуле аммиака NH3 равна трём, а атома серы в молекуле H2S равна двум, поскольку валентность атома водорода равна одному.
В соединениях Na2O, BaO, Al2O3, SiO2 валентности натрия, бария и кремния соответственно равны 1, 2, 3 и 4.
Понятие о валентности было введено в химию до того, как стало известно строение атома, а именно в 1853 году английским химиком Франклендом. В настоящее время установлено, что валентность элемента тесно связана с числом внешних электронов атомов, поскольку электроны внутренних оболочек атомов не участвуют в образовании химических связей.
В электронной теории ковалентной связи считают, что валентность атома определяется числом его неспаренных электронов в основном или возбуждённом состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Для некоторых элементов валентность является величиной постоянной. Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк — двухвалентны, алюминий — трёхвалентен и т. д. Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента — партнёра и условий протекания процесса. Так, железо может образовывать с хлором два соединения — FeCl2 и FeCl3, в которых валентность железа равна соответственно 2 и 3.
Степень окисления — понятие, характеризующее состояние элемента в химическом соединении и его поведение в окислительно-восстановительных реакциях; численно степень окисления равна формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому.
Электроотрицательность — мера способности атома к приобретению отрицательного заряда при образовании химической связи или способность атома в молекуле притягивать к себе валентные электроны, участвующие в образовании химической связи. Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
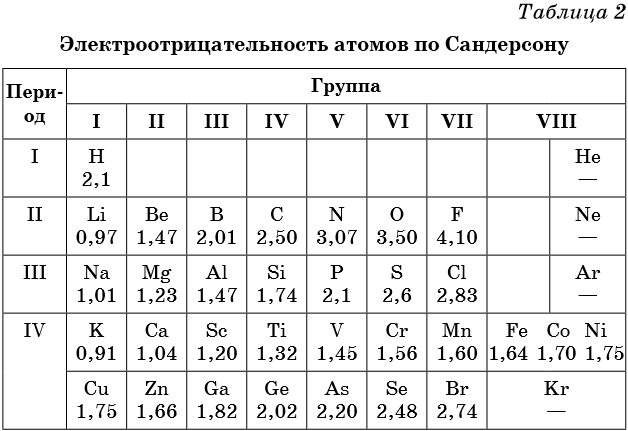
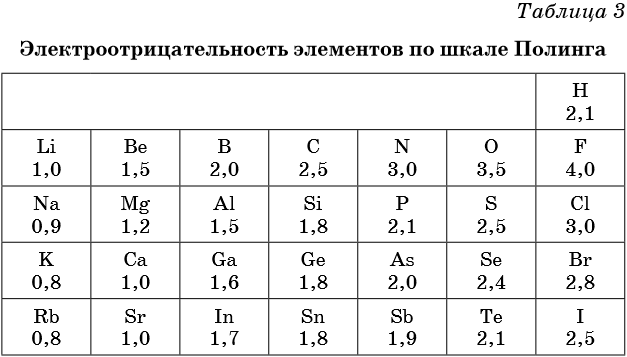
В таблице 2 приведена электроотрицательность некоторых химических элементов по шкале Сандерсона, а в таблице 3 — электроотрицательность элементов по шкале Полинга.
Значение электроотрицательности приведено под символом соответствующего элемента. Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным — атом рубидия. В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше — 3,5. Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
В молекуле аммиака NH3 значение электроотрицательности атома азота равно 3,0, а водорода — 2,1. Поэтому отрицательный заряд будет у атома азота, а положительный — у атома водорода.
Следует чётко знать общие тенденции изменения электроотрицательности. Поскольку атом любого химического элемента стремится приобрести устойчивую конфигурацию внешнего электронного слоя — октетную оболочку инертного газа, то электроотрицательность элементов в периоде увеличивается, а в группе электроотрицательность в общем случае уменьшается с увеличением атомного номера элемента. Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
При составлении формул соединений, состоящих из двух неметаллов, более электроотрицательный из них всегда ставят правее: PCl3, NO2. Из этого правила есть некоторые исторически сложившиеся исключения, например NH3, PH3 и т.д.
Степень окисления обычно обозначают арабской цифрой (со знаком перед цифрой), расположенной над символом элемента, например:
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
- Степень окисления элементов в простых веществах равна нулю.
- Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
- Кислород в соединениях проявляет главным образом степень окисления, равную –2 (во фториде кислорода OF2 + 2, в пероксидах металлов типа M2O2 –1).
- Водород в соединениях проявляет степень окисления + 1, за исключением гидридов активных металлов, например, щелочных или щёлочноземельных, в которых степень окисления водорода равна – 1.
- У одноатомных ионов степень окисления равна заряду иона, например: K+ — +1, Ba2+ — +2, Br– — –1, S2– — –2 и т. д.
- В соединениях с ковалентной полярной связью степень окисления более электроотрицательного атома имеет знак минус, а менее электроотрицательного — знак плюс.
- В органических соединениях степень окисления водорода равна +1.
Проиллюстрируем вышеприведённые правила несколькими примерами.
Пример 1. Определить степень окисления элементов в оксидах калия K2O, селена SeO3 и железа Fe3O4.
Оксид калия K2O. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Степень окисления кислорода в оксидах равна –2. Обозначим степень окисления калия в его оксиде за n, тогда 2n + (–2) = 0 или 2n = 2, отсюда n = +1, т. е. степень окисления калия равна +1.
Оксид селена SeO3. Молекула SeO3 электронейтральна. Суммарный отрицательный заряд трёх атомов кислорода составляет –2 × 3 = –6. Следовательно, чтобы уравнять этот отрицательный заряд до ноля, степень окисления селена должна быть равна +6.
Молекула Fe3O4 электронейтральна. Суммарный отрицательный заряд четырёх атомов кислорода составляет –2 × 4 = –8. Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Следует подчеркнуть, что степень окисления элемента в соединении может быть дробным числом. Такие дробные степени окисления не имеют смысла при объяснении связи в химическом соединении, но могут быть использованы для составления уравнений окислительно-восстановительных реакций.
Пример 2. Определить степень окисления элементов в соединениях NaClO3, K2Cr2O7.
Молекула NaClO3 электронейтральна. Степень окисления натрия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хлора за n, тогда +1 + n + 3 × (–2) = 0, или +1 + n – 6 = 0, или n – 5 = 0, отсюда n = +5. Таким образом, степень окисления хлора равна +5.
Молекула K2Cr2O7 электронейтральна. Степень окисления калия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Пример 3. Определим степени окисления серы в сульфат-ионе SO42–. Ион SO42– имеет заряд –2. Степень окисления кислорода равна –2. Обозначим степень окисления серы за n, тогда n + 4 × (–2) = –2, или n – 8 = –2, или n = –2 – (–8), отсюда n = +6. Таким образом, степень окисления серы равна +6.
Следует помнить, что степень окисления иногда не равна валентности данного элемента.
Например, степени окисления атома азота в молекуле аммиака NH3 или в молекуле гидразина N2H4 равны –3 и –2 соответственно, тогда как валентность азота в этих соединениях равна трём.
Максимальная положительная степень окисления для элементов главных подгрупп, как правило, равна номеру группы (исключения: кислород, фтор и некоторые другие элементы).
Максимальная отрицательная степень окисления равна 8 — номер группы.
Тренировочные задания
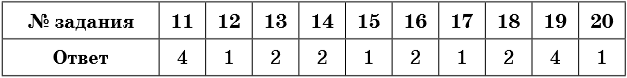
1. В каком соединении степень окисления фосфора равна +5?
1) HPO3
2) H3PO3
3) Li3P
4) AlP
2. В каком соединении степень окисления фосфора равна –3?
1) HPO3
2) H3PO3
3) Li3PO4
4) AlP
3. В каком соединении степень окисления азота равна +4?
1) HNO2
2) N2O4
3) N2O
4) HNO3
4. В каком соединении степень окисления азота равна –2?
1) NH3
2) N2H4
3) N2O5
4) HNO2
5. В каком соединении степень окисления серы равна +2?
1) Na2SO3
2) SO2
3) SCl2
4) H2SO4
6. В каком соединении степень окисления серы равна +6?
1) Na2SO3
2) SO3
3) SCl2
4) H2SO3
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) +2, +3, +6
2) +3, +6, +6
3) +2, +6, +5
4) +2, +6, +6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) номеру группы
4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3P
4) Ca3P2
11. Фосфор проявляет минимальную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3PO4
4) Ca3P2
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
1) –3, +3
2) –3, +5
3) +3, –3
4) +3, +5
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –2
2) II, –1
3) I, +4
4) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, +5
2) II, –1
3) II, +6
4) III, +4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –3
2) III, +3
3) IV, –2
4) III, +4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом
2) натрием
3) фтором
4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций
2) железо
3) сера
4) хлор
18. Степень окисления +3 в своих соединениях могут проявлять
1) хлор и фтор
2) фосфор и хлор
3) углерод и сера
4) кислород и водород
19. Степень окисления +4 в своих соединениях могут проявлять
1) углерод и водород
2) углерод и фосфор
3) углерод и кальций
4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор
2) железо
3) кислород
4) фтор