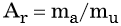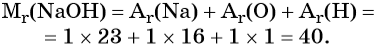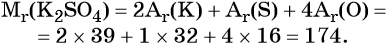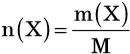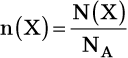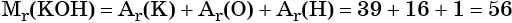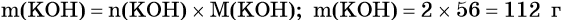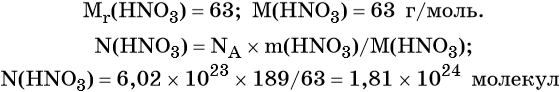Проведение расчетов на основе формул и уравнений реакций

Абсолютной атомной массой mа называют истинную массу атома элемента. Так как абсолютные атомные массы имеют очень малые значения (например, 1,993 × 10–26 кг для изотопа 12С), то для проведения физических и химических расчётов используют понятия атомной единицы массы. Атомной единицей массы (а. е. м., mu), или углеродной единицей, называют 1/12 часть массы атома изотопа углерода с массовым числом 12. Численное значение 1 а. е. м. = 1,667 · 10–27 кг.
Относительной атомной массой Аr называют массу атома, выраженную в атомных единицах массы:
Относительные атомные массы химических элементов приведены в периодической системе химических элементов возле символа соответствующего элемента. Следует отметить, что эти значения представляют собой среднюю величину из атомных масс всех природных изотопов этого элемента с учетом их относительного содержания в природе. При решении расчётных химических задач на школьном уровне обычно используют величины атомных масс, округлённые до целочисленных. Исключение составляет хлор, для которого обычно берут величину 35,5.
Относительной молярной массой Mr называют массу молекулы, выраженную в атомных единицах массы.
Относительная молярная масса простых и сложных веществ равна сумме относительных атомных масс атомов, входящих в состав молекулы. Например, относительная атомная масса кислорода О равна 16, молекулы кислорода O2 − 2 × 16 = 32, молекулы озона O3 − 3 × 16 = 48.
Относительная молярная масса гидроксида натрия NaOH равна:
Относительная молярная масса сульфата калия K2SO4 равна:
Количество вещества — физическое понятие, показывающее число структурных единиц (атомов, молекул, ионов и т. д.), образующих это вещество. Количество вещества обозначают греческой буквой ν или латинской буквой n. Единицей измерения количества вещества является моль, это одна из основных единиц системы СИ.
Моль — количество вещества, содержащее столько же структурных единиц, сколько содержится атомов в 0,012 кг изотопа углерода с массовым числом 12.
Молярной массой называют величину, равную отношению массы вещества к количеству вещества. Численно молярная масса всегда совпадает с массой молекулы, выраженной в атомных единицах массы. Единица измерения молярной массы г/моль.
Число структурных элементов (атомов, молекул, ионов и т. д.) в одном моле вещества называют числом или постоянной Авогадро, это число равно 6,02 × 1023 моль–1. Значение числа Авогадро необходимо запомнить.
Масса, молярная масса и количество вещества некоего вещества Х связаны между собой формулой:
где m(X) — масса вещества Х; M(X) — его молярная масса.
Количество вещества также можно определить по формуле:
где N(X) — число частиц вещества Х; NA — число Авогадро.
Пример 1. Определить массу гидроксида калия количеством вещества 2 моль.
Определим Mr(KOH):
Следовательно, молярная масса М(KOH) равна 56 г/моль.
Пример 2. Сколько молекул содержится в азотной кислоте массой 189 г?