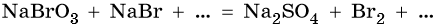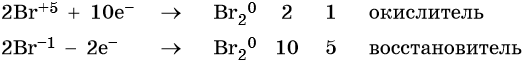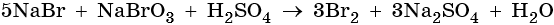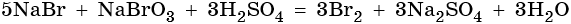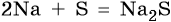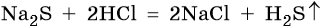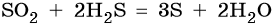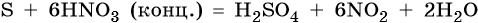Анализ отдельных заданий высокого уровня сложности (часть 2)

Задания, посвященные окислительно-восстановительным реакциям.
Они посвящены реакциям окислительно-восстановительным. Теоретический материал по химии неорганических соединений изложен в уроках 11–19; правила составления уравнений реакций методом электронного баланса вы найдете в уроке 8. При ответе на задания такого рода необходимо логически вычислить и обосновать пропущенные исходные вещества или продукты реакции.
Пример. Используя метод электронного баланса, составьте уравнение реакции. Укажите окислитель и восстановитель:
Бромат натрия является сильным окислителем. Он окисляет бромид натрия (восстановитель) до брома (реакция конмутации). Так как в правой части уравнения присутствуют сульфат-ионы, то их донором в левой части должны быть молекулы серной кислоты. Тогда недостающим веществом в правой части будет вода, в которую будут связываться катионы водорода из молекулы серной кислоты и ионы кислорода из бромата натрия.
В этой реакции бромат натрия является окислителем. Два атома брома изменяют свою степень окисления от +5 до 0, принимая при этом 10 электронов.
Бромид натрия является восстановителем. Два атома брома изменяют свою степень окисления от –1 до 0, отдавая при этом два электрона.
Составляем уравнения электронного баланса и уравниваем число присоединенных и отданных электронов:
Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктом окисления и восстановления в правой части уравнения реакции:
По количеству ионов натрия в правой части уравнения определяем число молекул серной кислоты в левой части уравнения. Уравниваем реакцию, поставив коэффициент перед молекулой воды, в окончательном виде получаем:
Основы неорганической химии.
В этих заданиях проверяется знание реакций, подтверждающих взаимосвязь различных классов неорганических веществ. Теоретический материал изложен в уроках 11–19. Напомним, что обменные химические реакции идут до конца, если в результате таких реакций образуется осадок, выделяется газ или вода, а также выделяется большое количество энергии. Закономерности протекания окислительно-восстановительных реакций изложены в уроках 11–19, уроке 8.
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
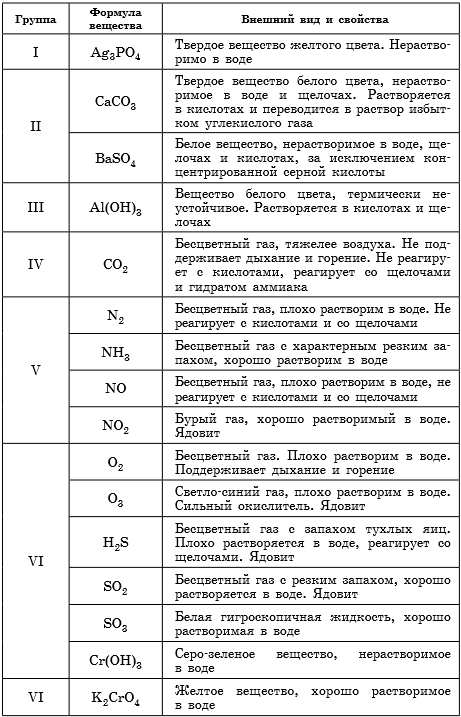
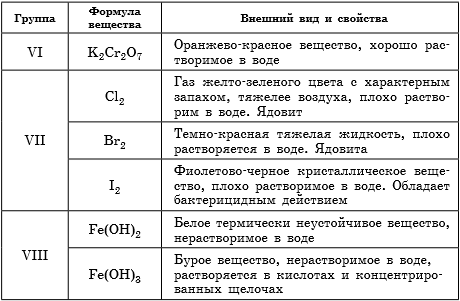
Описание качественных реакций, используемых для определения некоторых катионов и анионов приводится в Приложении к данной книге.
В таблице 9 представлены сведения о внешнем виде и свойствах некоторых распространенных веществ и соединений, используемых при описании внешних признаков протекания химической реакции.
Пример. Натрий сплавили с серой. Образовавшееся соединение обработали соляной кислотой, выделившийся газ нацело прореагировал с оксидом серы (IV). Образовавшееся вещество обработали концентрированной азотной кислотой. Напишите уравнения описанных реакций.
Сплавление натрия с серой приведет к образованию сульфида натрия:
Под действием соляной кислоты произойдет обменная реакция, и сероводород уйдет из сферы реакции:
Взаимодействие сероводорода с оксидом серы (IV) приведет к образованию серы и воды:
Окисление серы концентрированной азотной кислотой даст серную кислоту, оксид азота (IV) и воду: