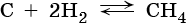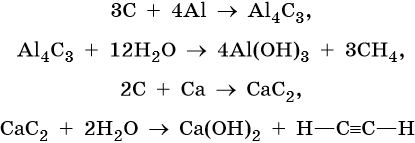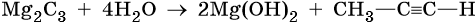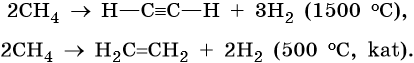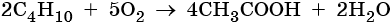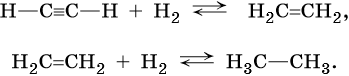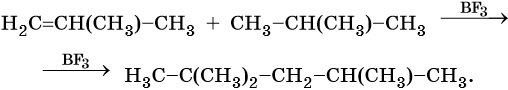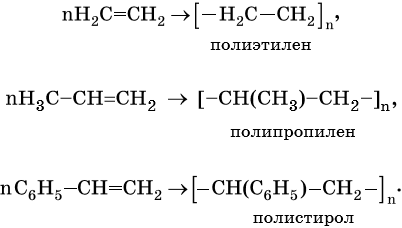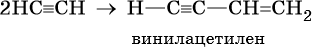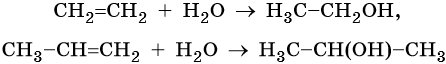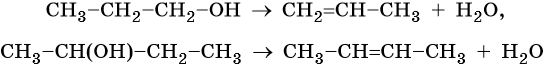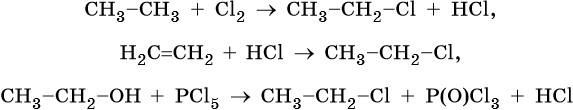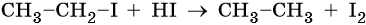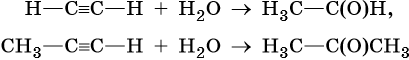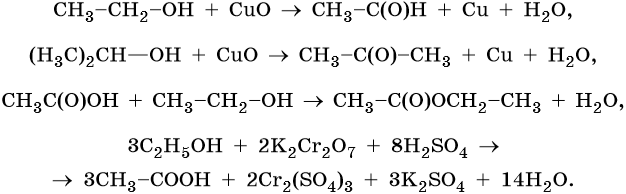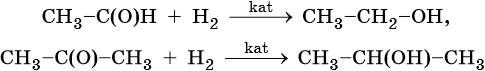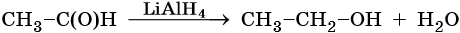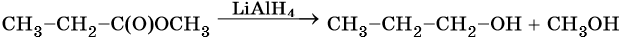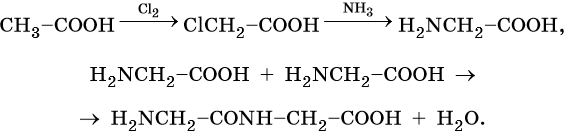Анализ отдельных заданий повышенного уровня сложности с кратким ответом

Содержание
- Электролиз расплавов и растворов (солей, щелочей, кислот)
- Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
- Задания, проверяющие знания химических свойств неорганических веществ и соединений.
- Задания, проверяющие знания основ аналитической химии.
- Задания, предназначенные для проверки знаний основ химии углеводородов.
- Задания, предназначенные для проверки знаний основ химии кислородсодержащих соединений.
- Приложения
Электролиз расплавов и растворов (солей, щелочей, кислот)
Пример. Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Бромид натрия. Натрий стоит в ряду напряжений металлов до алюминия. Следовательно, при электролизе водного раствора NaBr на катоде выделится водород. При электролизе бромидов на аноде выделяется галоген. Ответ: 5.
Хлорид меди (II). Медь стоит в ряду напряжений металлов после водорода. Следовательно, при электролизе водного раствора CuCl2 на катоде выделится металл. При электролизе хлоридов на аноде выделяется галоген. Ответ: 1.
Сульфат хрома (III). Хром стоит в ряду напряжений металлов после алюминия, но до водорода. Следовательно, при электролизе водного раствора Cr2(SO4)3 на катоде будут одновременно выделяться металл и водород. При электролизе сульфатов на аноде выделяется кислород. Ответ: 2.
Нитрат серебра. Серебро стоит в ряду напряжений металлов после водорода. Следовательно, при электролизе водного раствора AgNO3 на катоде выделится металл. При электролизе нитратов на аноде выделяется кислород. Ответ: 3.
Ответ: А – 5; Б – 1; В – 2; Г – 3;
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
Теоретический материал по этой теме изложен в уроке 7.
Пример. Установите соответствие между названием соли и ее способностью к гидролизу.
Ацетат лития и сульфид калия — это соли, образованные сильными основаниями и слабыми кислотами. Они гидролизуются по аниону, реакция среды щелочная. Нитрат кобальта образован сильной азотной кислотой и слабым основанием — гидроксидом кобальта. Гидролиз по катиону, реакция среды кислая. Сульфид алюминия образован слабым основанием и слабой кислотой. Соль полностью гидролизуется.
Ответ: А – 3; Б – 2; В – 3; Г – 4;
Задания, проверяющие знания химических свойств неорганических веществ и соединений.
Они посвящены характерным химическим свойствам неорганических веществ: простых веществ-металлов: щелочных, щелочноземельных, алюминия, переходных металлов — меди, цинка, хрома, железа; простых веществ-неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния; оксидов: оснОвных, амфотерных, кислотных; оснований и амфотерных гидроксидов; кислот; солей: средних, кислых, оснОвных; комплексных (на примере соединений алюминия и цинка). Теоретический материал по данной категории вопросов очень обширный и изложен в уроках 1-19 настоящего пособия. Для ответа на соответствующие тесты необходимо хорошо знать основные химические свойства простых веществ и основных классов неорганических соединений.
Пример. Установите соответствие между формулой вещества и реагентами, с каждым из которых оно может взаимодействовать.
Оксид калия проявляет ярко выраженные оснОвные свойства. Он реагирует с водой с образованием гидроксида калия; с соляной кислотой с образованием хлорида калия и воды; при его сплавлении с амфотерным оксидом алюминия образуется диоксоалюминат (III) калия.
Хлор — активный неметалл. При его взаимодействии с фосфором, в зависимости от соотношения реагентов, может образоваться хлорид фосфора (III) или хлорид фосфора (V); с серой — хлориды серы различного состава; с железом — хлорид железа (III).
Оксид серы (IV) вступает с сероводородом в окислительно-восстановительную реакцию с образованием серы и воды; окисляется кислородом до оксида серы (VI); с гидроксидом натрия образует, в зависимости от соотношения реагентов, либо гидросульфит натрия, либо сульфит натрия и воду.
Разбавленная серная кислота реагирует с железом с образованием сульфата железа (II) и водорода; при ее взаимодействии с амфотерными оксидами алюминия и цинка образуются соответствующие соли и вода.
Ответ: А – 1; Б – 2; В – 5; Г – 3;
Задания, проверяющие знания основ аналитической химии.
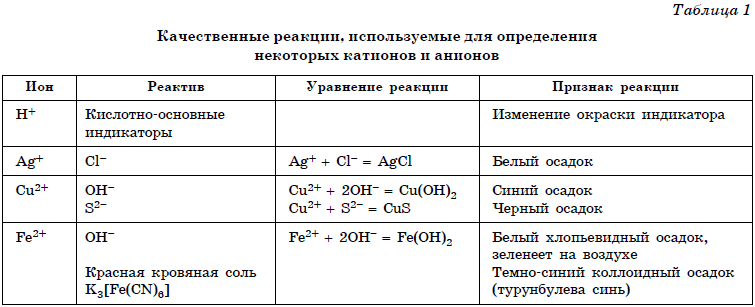
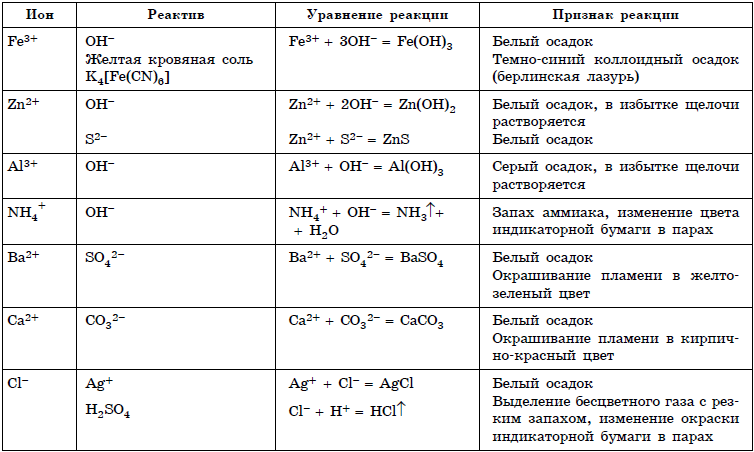
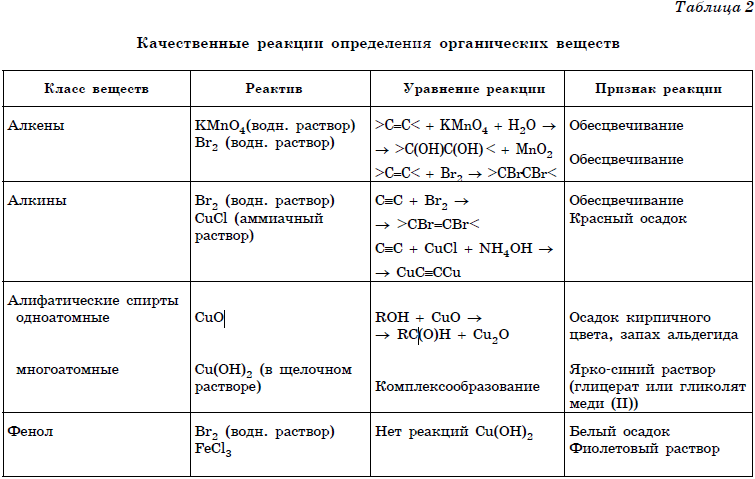
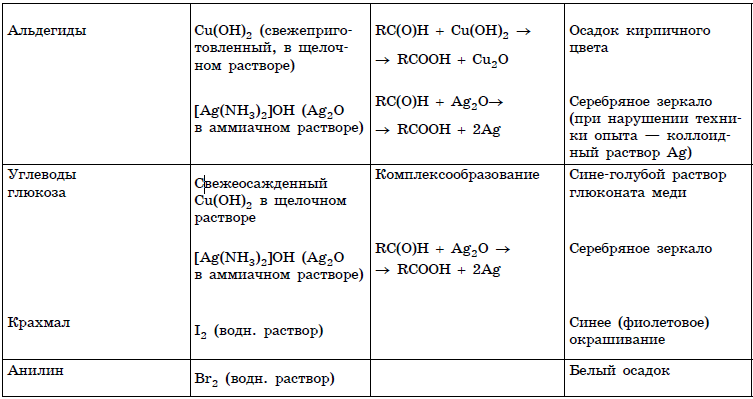
Следующий тип заданий предназначен проверке знаний основ аналитической химии, а именно качественным реакциям на неорганические вещества и ионы и качественным реакциям органических соединений. Данные реакции описаны в приложениях № 1 и 2 в конце данного урока, а теоретический материал — в уроках 11-31.
Пример. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
Этанол, в отличие от метилэтилкетона, будет реагировать с металлическим натрием с выделением водорода. Гексин-2 будет обесцвечивать бромную воду, а диэтиловый эфир с ней реагировать не будет. Анилин при взаимодействии с бромной водой даст осадок триброманилина, а три этиламин в реакцию с ней не вступит. Также бромная вода позволит отличить октен-1 (наблюдаем обесцвечивание) от бензола (с бромной водой не реагирует).
Ответ: А – 2; Б – 3; В – 3; Г – 3;
Задания, предназначенные для проверки знаний основ химии углеводородов.
Они посвящены характерным химическим свойствам углеводородов: алканов, алкенов, диенов, алкинов. Проверяются знания механизмов реакций замещения и присоединения в органической химии. Правило В.В. Марковникова. Теоретический материал к данным тестам вы найдете в уроке 21. Ответ на данную группу тестов возможен только при хороших знаниях химических свойств и методов получения углеводородов.
Пример. Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с эквимольным количеством брома: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Для малых циклов при взаимодействии с бромом характерно их раскрытие. Продуктом этой реакции будет 1,3-диромбутан. Для соединений с двойной связью, к которым относятся все остальные перечисленные в задании углеводороды, характерна реакция соединения, в ходе которой происходит разрыв двойной связи, а атомы брома встанут у соседних атомов углерода. Поэтому циклогексен даст 1,2-дибромциклогексан, бутен-1 — 1,2-дибромбутан, а бутен-2 — 2,3-дибромутан.
Ответ: А – 5; Б – 6; В – 2; Г – 4;
Задания, предназначенные для проверки знаний основ химии кислородсодержащих соединений.
Они посвящены характерным химическим свойствам предельных одноатомных и многоатомных спиртов; фенола; альдегидов, предельных карбоновых кислот, сложных эфиров. При ответе на эту категорию заданий нужно продемонстрировать хорошие знания химических свойств и методов получения соответствующих соединений.
Весь необходимый теоретический материал вы найдете в уроках 22—25.
Пример. Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
При взаимодействии спиртов со щелочными металлами образуются соответствующие алкоголяты и выделяется водород. Реакция муравьиной кислоты с метанолом приведет к сложному эфиру и воде. При присоединении уксусной кислоты к ацетилену (реакция винилирования) образуется сложный эфир — винилацетилен. Окисление этаналя перманганатом калия в щелочной среде даст ацетат калия.
Ответ: А – 5; Б – 4; В – 2; Г – 1;
Приложения
Качественные реакции (Приложение 1)
В таблицах 1 и 2 приведены качественные реакции на неорганические ионы и функциональные группы органических соединений. Качественные реакции, используемые для определения отдельных классов органических соединений, приведены в таблице 2.
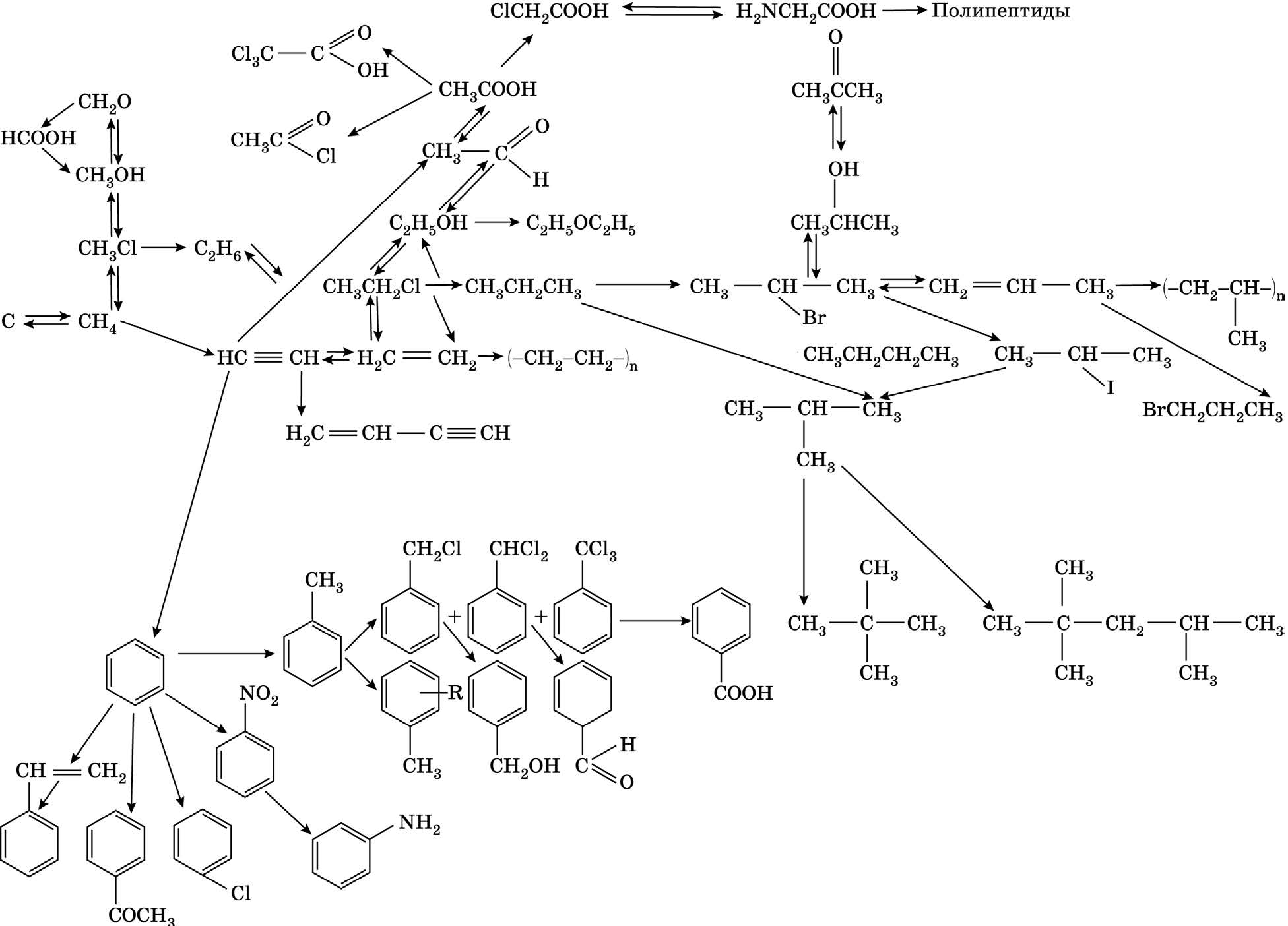
Гомологическая связь между классами органических соединений (Приложение 2)
Все классы органических соединений связаны между собой и способны к взаимным переходам. При этом из неорганических веществ можно получить органические и наоборот.
Рассмотрим эти превращения на простейших примерах.
Переход от углерода к органическим соединениям класса углеводородов возможен несколькими путями. Например, прямой синтез метана из неорганических веществ:
Эта реакция протекает при повышенном давлении, температуре 600 °С, на платиновом катализаторе. Обратная реакция разложения метана идет при 1000 °С.
Углеводороды можно получить и через стадии соответствующих карбидов металлов. Последние делят на метаниды (карбиды бериллия и алюминия, при их гидролизе образуется метан) и ацетелиниды (карбиды кальция, калия, цинка, серебра, меди, при их гидролизе образуется ацетилен):
Особое направление гидролиза у карбида магния, при этом образуется пропин:
Из метана можно получить углеводороды класса алкенов и алкинов:
Каталитическое окисление бутана приводит к уксусной кислоте:
Предельные и непредельные углеводороды способны к взаимному переходу:
Предельные углеводороды способны реагировать с непредельными. Так, взаимодействие изобутана с 2-метилпропеном приводит к 2,2,4-триметилпентану (изооктану). Реакция протекает в присутствии фторида бора или концентрированной серной кислоты:
Полимеризация непредельных углеводородов дает различные полимеры:
Из ацетилена возможно получение винилацетилена — соединения, содержащего в себе одновременно двойные и тройные связи. Эта реакция проходит в подкисленном водном растворе в присутствии хлорида аммония и хлорида меди (I):
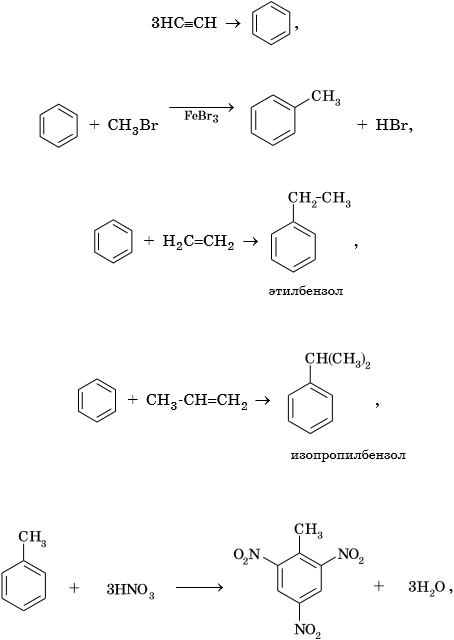
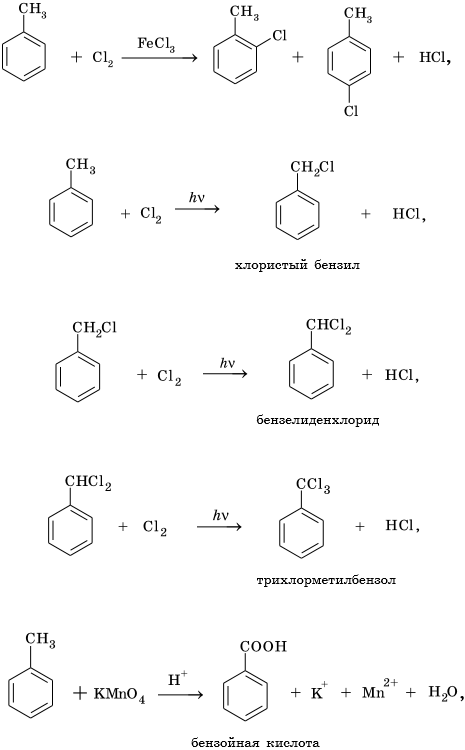
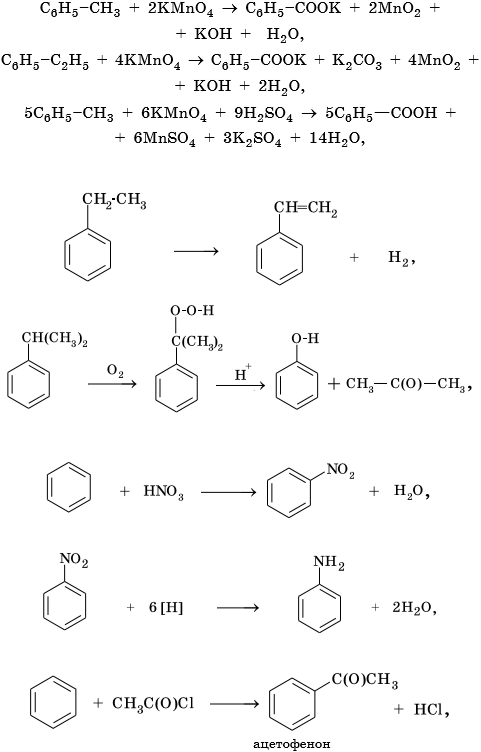
Из ацетилена также возможно получение ароматического углеводорода — бензола, затем — его гомологов: толуола, этилбензола, изопропилбензола и далее — многочисленных функциональных производных:
Из алкенов возможно обратимое получение спиртов. Реакция катализируется минеральными кислотами (серной или фосфорной):
Обратная реакция получения алкенов идет в присутствии концентрированной серной кислоты при температуре выше 150 °С или катализе хлоридом цинка. Реакция идет по правилу Зайцева:
Галоидные алкилы можно получать различными способами: прямым галогенированием алканов, гидрогалогенированием алкенов, реакцией спиртов с галогенидами фосфора или галогенводородами:
Восстановление йодистого алкила йодоводородом приведет к алкану:
Дегидрогалогенирование галоидных алкилов приводит к алкенам:
Из алкинов возможно получение альдегидов и кетонов:
Спирты, альдегиды, карбоновые кислоты и сложные эфиры способны к взаимному переходу:
Восстановление альдегидов и кетонов водородом протекает в присутствии в качестве катализаторов никеля Ренея (скелетного никеля), платины, палладия и других катализаторов. При этом альдегиды восстанавливаются в первичные спирты, кетоны — во вторичные:
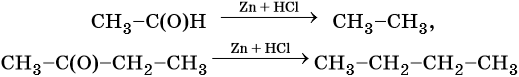
Реакция альдегидов или кетонов с амальгамированным цинком и концентрированной соляной кислотой (восстановление по Клеменсену) приводит к алканам:
Карбоновые кислоты и сложные эфиры восстанавливаются в спирты под действием алюмогидрида лития:
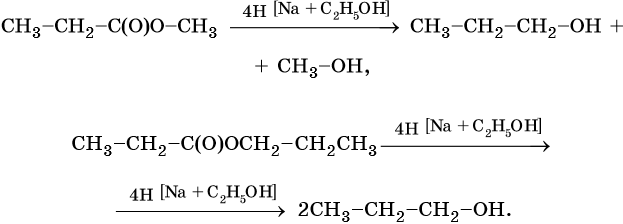
Другой вариант проведения этой реакции — восстановление сложных эфиров карбоновых кислот избытком натрия в этаноле. При этом, в зависимости от строения сложного эфира, образуется или смесь спиртов, или один спирт:
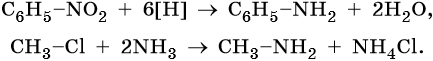
Амины можно получить восстановлением нитросоединений или алкилированием аммиака галоидными алкилами:
И наконец, из карбоновых кислот возможно получение аминокислот, далее пептидов и белков:
Все органические вещества горят в избытке кислорода. При этом образуются углекислый газ, вода, а в случае наличия в молекуле органического вещества гетероатомов — продукты его окисления.
Таким образом, практически все органические соединения способны к взаимным превращениям.