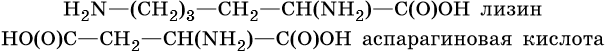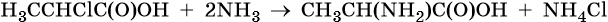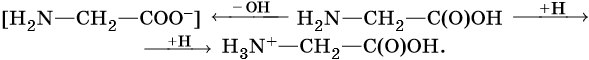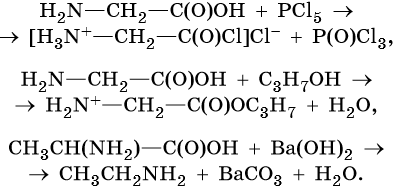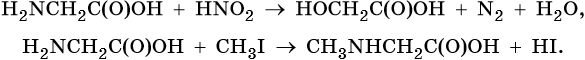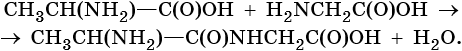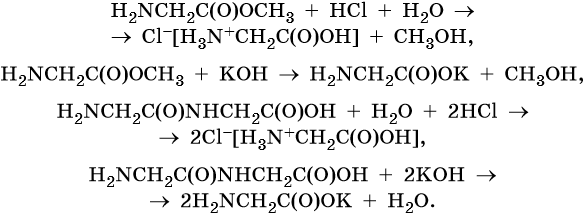Аминокислоты, пептиды и белки

Аминокислотами называют соединения, которые содержат в своем составе одновременно карбоксильную и аминогруппы. Родоначальником этого класса соединений является аминоуксусная кислота, или глицин, — H2N–CH2–C(O)OH. Изомерия аминокислот определяется изомерией углеродной цепи и изомерией положения аминогруппы по отношению к карбоксильной группе. Наиболее важными в биологическом отношении являются α-аминокислоты. Во всех белковых веществах постоянно встречаются 20 аминокислот.
В молекулах аминокислот могут содержаться и несколько амино- и карбоксильных групп, например:
Основным способом получения аминокислот является взаимодействие α-хлорзамещенных карбоновых кислот с аммиаком, например:
Моноаминокарбоновые кислоты представляют собой внутренние соли, которые образуются при переходе протона от карбоксильной группы к аминогруппе:
Их называют также цвиттер-ионами, или биполярными ионами. В кислой среде эти ионы ведут себя как катионы, а в щелочной — как анионы, что иллюстрирует следующая схема:
Аминокислоты проявляют свойства, характерные как для кислот, так и для аминов.
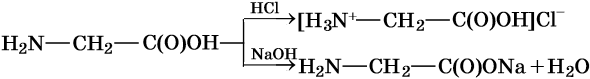
Реакции по карбоксильной группе:
Реакции по аминогруппе:
Образование пептидов:
Пептидами называют природные и синтетические вещества, построенные из остатков аминокислот, соединенных пептидными связями:
Ниже приведены уравнения реакций кислотного и щелочного гидролиза сложных эфиров аминокислот и пептидов:
К белкам относят полипептиды, содержащие в своем составе больше 100 аминокислотных остатков. Их молекулярная масса лежит в пределах от 10 000 до нескольких миллионов.
В соответствии с числом аминокислотных остатков пептиды делят на олигопептиды и полипептиды. В состав олигопептидов (низкомолекулярных пептидов) входят не более 10 аминокислотных остатков. В состав цепи полипептидов входят от 10 до 100 аминокислотных остатков.
По химическому составу белки делят на протеины, т. е. белки, при гидролизе которых образуются только аминокислоты (простые белки), и протеиды, т. е. соединения, при гидролизе которых, кроме аминокислот, выделяются и другие компоненты. Эта неаминокислотная часть сложного белка называется простетической группой.
По форме молекул различают глобулярные (шаровидные) и фибриллярные (нитевидные) белки.
К глобулярным белкам относят альбумины и глобулины (широко распространенные в органах и тканях организма), а к фибриллярным — коллаген (основной белок соединительной ткани).
Последовательность аминокислотных звеньев в линейной полипептидной цепи называют первичной структурой белка.
Вторичной структурой белка называют форму полипептидной цепи в пространстве. Вторичная структура определяется тем, что из-за образования внутримолекулярных водородных связей макромолекулы принимают определенную конформацию. Часто вторичная структура представляет собой спираль.
Третичная структура определяется пространственным расположением макромолекулы как целого и зависит, например, от взаимодействия полярных и неполярных заместителей в разных местах цепи, от образования S—S-связей между противоположными цистеиновыми остатками.
Четвертичной структурой белка называют сложные образования из отдельных молекул белка.
Денатурацией белка называют процесс потери им его естественных свойств. Денатурация происходит под действием высоких температур или активных химических веществ, при этом происходит нарушение всех структур белковой молекулы, за исключением первичной.