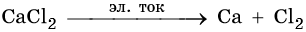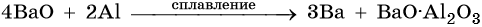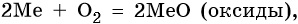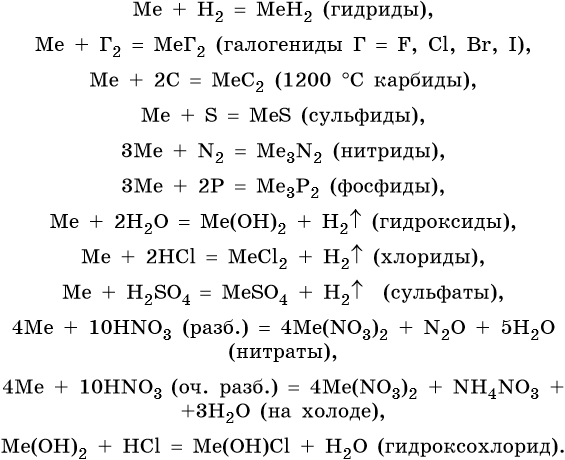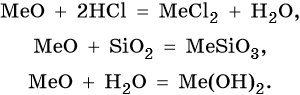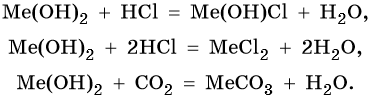Элементы группы IIA

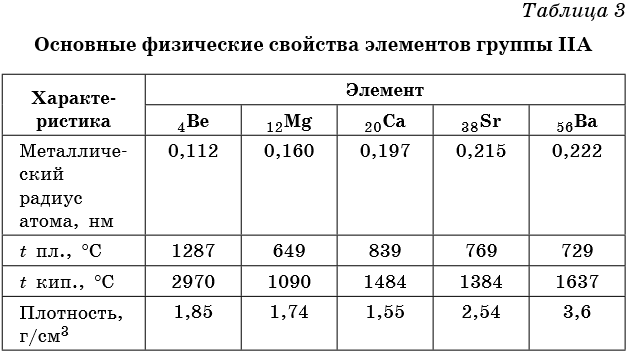
Элементами группы IIА являются бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra. Последние три называют элементами подгруппы кальция или щелочноземельными металлами. Некоторые свойства элементов группы IIА приведены в таблице 3.
Свойства бериллия и магния несколько отличаются от свойств, характерных для щелочноземельных металлов. Бериллий по многим свойствам близок к алюминию, а магний — к цинку.
Для щелочноземельных металлов наблюдается общая для Периодической системы закономерность: с увеличением порядкового номера возрастает радиус атома элемента и его металлические свойства.
Магний и кальций получают электролизом расплавов их хлоридов, например:
Стронций и барий получают восстановлением их оксидов алюминием или кремнием, например:
Щелочноземельные металлы химически активны; они легко реагируют с простыми и сложными веществами, в своих соединениях проявляют степень окисления +2.
Ниже приведены характерные для щелочноземельных металлов реакции с простыми и сложными веществами (Me = Mg, Ca, Sr, Ba):
Оксиды щелочноземельных металлов представляют собой типичные оснОвные оксиды. Они реагируют с кислотами с образованием солей и воды, с кислотными оксидами с образованием солей. Реакция с водой протекает по-разному. Если оксид бария легко реагирует с водой при комнатной температуре с образованием сильной щелочи Ba(OH)2, то оксид магния может реагировать с водой только при кипячении. Химические свойства оксида магния и оксидов щелочноземельных металлов (Me = Mg, Ca, Sr, Ba):
Гидроксиды щелочноземельных металлов проявляют оснОвные свойства: реагируют с кислотами с образованием оснОвных или средних солей и воды, с кислотными оксидами с образованием солей и воды. Химические свойства гидроксида магния и гидроксидов щелочноземельных металлов (Me = Mg, Ca, Sr, Ba):
Сила оснований увеличивается с увеличением порядкового номера элемента.
Соли кальция окрашивают пламя газовой горелки в коричнево-красный цвет; стронция — в ярко-красный цвет; бария — в желто-зеленый цвет.