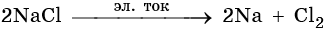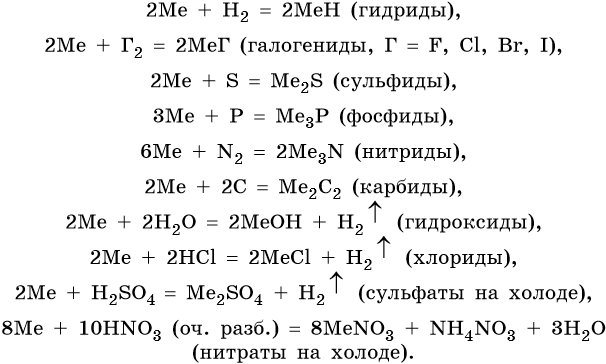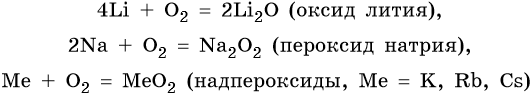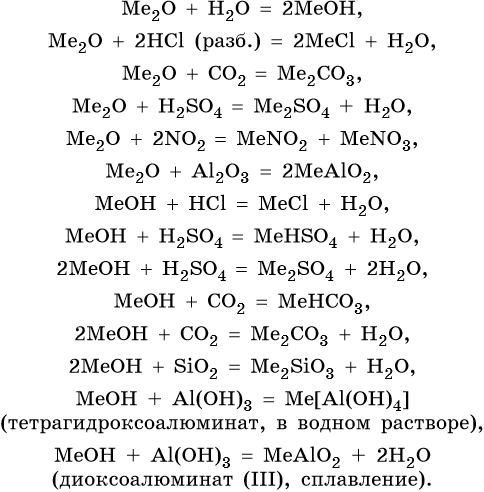Элементы группы IA

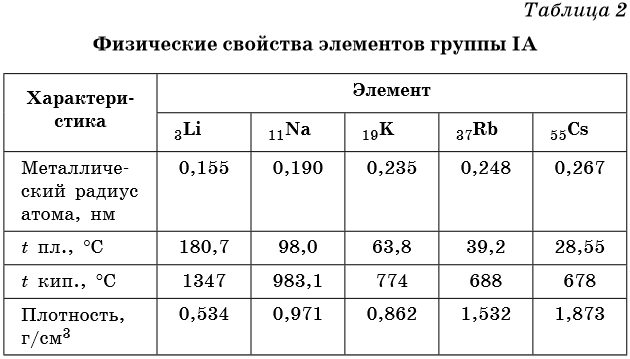
Элементами группы IA являются литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Их называют также щелочными металлами. Некоторые их физические свойства приведены в таблице 2.
Для щелочных металлов наблюдается общая для Периодической системы закономерность: с увеличением порядкового номера возрастает радиус атома элемента и его металлические свойства.
Общий способ получения щелочных металлов — электролиз расплавов их хлоридов, например:
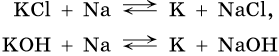
Калий получают также с помощью натрийтермического метода:
Щелочные металлы химически очень активны, легко реагируют с простыми и сложными веществами; в своих соединениях проявляют степень окисления +1.
Хранят щелочные металлы в герметичных емкостях под слоем обезвоженного керосина, литий — под слоем вазелина.
Ниже представлены общие для всех щелочных металлов реакции (Me = Li, Na, K, Rb, Cs).
Исключением является реакция с кислородом, в которой щелочные металлы ведут себя по-разному:
Оксиды щелочных металлов Me2O являются типичными оснОвными оксидами, а гидроксиды ЭОН — сильными основаниями (щелочами), сила которых возрастает от лития к цезию.
Гидроксиды щелочных металлов плавятся без разложения, за исключением гидроксида лития, который при температуре выше температуры плавления разлагается на оксид лития и воду.
Соли щелочных металлов окрашивают пламя газовой горелки: литий — в темно-красный цвет; натрий — в желтый; калий — в фиолетовый; цезий — в синий.