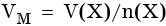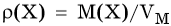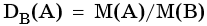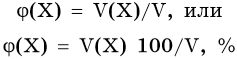Газовые законы

Закон Авогадро: в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Следствия из закона Авогадро:
- Одинаковое число молекул разных газов при одинаковых условиях будет занимать одинаковый объем;
- При нормальных условиях (н. у.), т. е. при температуре 0 °С (273 K) и давлении 1,013 · 105 Па (1 атм., 760 мм рт. ст.), моль любого газа занимает объем 22,4 л. Этот объем называют молярным объемом газа при н. у. (VM), единица его измерения л/моль.
Молярный объем представляет собой частное от деления объема газа на количество вещества газа:
Плотность газа при нормальных условиях можно определить по формуле:
где ρ(Х) — плотность газа, г/л; М(Х) — молярная масса газа, г/моль; VM — молярный объем, л/моль.
При одинаковых внешних условиях плотности газов находятся в таком же соотношении, как и их молекулярные массы. Следовательно, если известны молекулярные массы двух газов, можно вычислить плотность одного газа по отношению к другому газу.
Относительной плотностью газа А по газу В, DB(A), называют отношение массы определенного объема одного газа к массе такого же объема другого газа в одних и тех же условиях:
Объемная доля φ показывает долю объема данного компонента X от общего объема системы V:
Закон объемных соотношений. Объемы газов, участвующих в реакции, относятся друг к другу как небольшие целые числа, равные коэффициентам в уравнении реакции.
Коэффициенты в уравнениях реакций показывают числа объемов реагирующих и образовавшихся газообразных веществ.