Химическая связь

Химическая связь — электростатическое взаимодействие между электронами и ядрами, приводящее к образованию молекул.
Химическую связь образуют валентные электроны. У s- и p-элементов валентными являются электроны внешнего слоя, у d-элементов — s-электроны внешнего слоя и d-электроны предвнешнего слоя. При образовании химической связи атомы достраивают свою внешнюю электронную оболочку до оболочки соответствующего благородного газа.
Длина связи — среднее расстояние между ядрами двух химически связанных между собой атомов.
Энергия химической связи — количество энергии, необходимое для разрыва химической связи, когда вещество находится в газовой фазе.
Известны четыре основных типа химической связи: ковалентная, ионная, металлическая и водородная.
Ковалентной называют химическую связь, образованную за счет образования общей электронной пары.
Если связь образует пара общих электронов, в равной мере принадлежащая обоим соединяющимся атомам, то ее называют ковалентной неполярной связью. Эта связь существует, например, в молекулах H2, N2, O2, F2, Cl2, Br2, I2. Ковалентная неполярная связь возникает между одинаковыми атомами, а связующее их электронное облако равномерно распределено между ними.
В молекулах между двумя атомами может формироваться различное число ковалентных связей (например, одна в молекулах галогенов F2, Cl2, Br2, I2, три — в молекуле азота N2).
Ковалентная полярная связь возникает между атомами с разной электроотрицательностью. Образующая ее электронная пара смещается в сторону более электроотрицательного атома, но остается связанной с обоими ядрами. Примеры соединений с ковалентной полярной связью: HBr, HI, H2S, N2O и т. д.
Ионной называют предельный случай ковалентной полярной связи, при которой электронная пара полностью переходит от одного атома к другому и связанные частицы превращаются в ионы.
Строго говоря, к соединениям с ионной связью можно отнести лишь соединения, для которых разность в электроотрицательности больше 3, но таких соединений известно очень мало. К ним относят фториды щелочных и щелочноземельных металлов. Условно считают, что ионная связь возникает между атомами элементов, разность электроотрицательности которых составляет величину больше 1,7 по шкале Полинга. Примеры соединений с ионной связью: NaCl, KBr, Na2O.
Металлической называют химическую связь между положительными ионами в кристаллах металлов, которая осуществляется в результате притяжения электронов, свободно перемещающихся по кристаллу металла.
Атомы металлов превращаются в катионы, формируя металлическую кристаллическую решетку. В этой решетке их удерживают общие для всего металла электроны (электронный газ).
Водородная связь бывает межмолекулярной и внутримолекулярной. В общем виде межмолекулярная водородная связь — это связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом (О, N, F) другой молекулы.
Внутримолекулярная водородная связь возникает, если в молекуле одновременно имеются группы с донорной и акцепторной способностями. Именно внутримолекулярные водородные связи играют основную роль в образовании пептидных цепей, которые определяют строение белка.
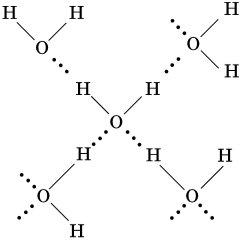
Например, в воде водородная связь возникает благодаря электростатическому и донорно-акцепторному взаимодействию между атомом водорода и атомом кислорода, который ковалентно не связан с данным атомом водорода. Обозначают водородную связь тремя точками:
Энергия водородной связи на порядок ниже энергии ковалентной связи. Кроме воды водородные связи существуют, например, во фтороводороде, аммиаке, спиртах, карбоновых кислотах.