Урок 16. Кислород и озон
В уроке 16 «Кислород и озон» из курса «Химия для чайников» мы рассмотрим кислород как химический элемент и как простое вещество; узнаем об истории его открытия; выясним, что такое озон и какими свойствами он обладает.
Исторически так сложилось, что химический элемент и одно из простых веществ, образованных атомами этого элемента, имеют общее название — кислород. Поскольку между этими понятиями существует принципиальная разница, следует четко различать, о чем идет речь — о кислороде как о химическом элементе или о простом веществе.
Содержание
Кислород как химический элемент
Самым первым химическим элементом, к изучению которого мы приступаем, является кислород. Как вы уже знаете, химический знак кислорода — О. Относительная атомная масса кислорода равна 16:
Позднее вы узнаете, какое строение имеет атом кислорода и чем он отличается от атомов других химических элементов.
Когда говорят о кислороде как о химическом элементе, то подразумевают атомы кислорода. Например: «В состав многих сложных веществ входит кислород», «Массовая доля кислорода в глюкозе равна 53,3 %». В этих примерах речь идет об атомах кислорода (О), которые наряду с атомами других химических элементов входят в состав сложных веществ, следовательно, в данном случае речь идет о кислороде как о химическом элементе.
Кислород как простое вещество
Простое вещество кислород существует в виде молекул. Молекула кислорода состоит из двух атомов химического элемента кислорода (рис. 73), поэтому химическая формула кислорода как простого вещества — O2.
Поскольку относительная атомная масса кислорода равна 16, то относительная молекулярная масса простого вещества кислорода равна:
Следовательно, молярная масса кислорода равна:
Как у всех газов, молярный объем кислорода при нормальных условиях равен:
Когда говорят о кислороде как о простом веществе, то подразумевают вещество, имеющее формулу О2. Например: «Железные изделия быстро ржавеют в атмосфере влажного кислорода», «Для горения древесины необходим кислород». В этих примерах речь идет о веществе, имеющем формулу О2.
История открытия кислорода
История открытия самого важного для человека газа была долгой и запутанной. Впервые об открытии кислорода было сообщено в 1774 г. английским химиком Дж. Пристли. Он получил его при нагревании вещества HgO. Однако Дж. Пристли в то время не понял, что он получил новое газообразное вещество, и считал его разновидностью воздуха. Еще раньше в 1772 г. кислород был получен К. Шееле, но сообщение об этом он опубликовал только в 1777 г.
В 1774 г. Дж. Пристли сообщил о своих результатах великому французскому химику А. Лавуазье. Он тут же начал свои опыты и уже в 1775 г. сделал в Академии наук доклад «Мемуар о природе вещества, соединяющегося с металлами при прокаливании и увеличивающего их вес».
Происхождение названия «кислород» связано с образованием кислот в результате растворения в воде некоторых сложных веществ, содержащих атомы этого элемента. А. Лавуазье считал, что кислород — это обязательная составная часть всех кислот, что он «рождает» кислоты. Чтобы подчеркнуть это, А. Лавуазье в 1779 г. назвал этот газ «рождающим кислоты», или сокращенно — кислородом.
Озон
Кроме кислорода, существует еще одно простое вещество, молекулы которого состоят только из атомов кислорода. Это озон, молекула которого содержит три атома кислорода (рис. 74), его формула — О3.
При нормальных условиях озон представляет собой газ с резким раздражающим запахом. Он очень токсичен для всех живых организмов и поэтому используется вместо хлора для обеззараживания воды.
Небольшие количества озона образуются в воздухе во время грозы, а также в результате взаимодействия смолы хвойных деревьев с кислородом. Озон оказывает губительное действие на бактерии, поэтому лесной воздух (особенно в хвойных лесах) обладает целебным действием.
В небольших количествах озон образуется также при работе копировальных аппаратов и лазерных принтеров. Использовать такие приборы следует только в хорошо проветриваемых помещениях.
В верхних слоях атмосферы Земли (на высоте примерно 30—40 км) существует озоновый слой. Содержащийся в нем озон образуется из кислорода под воздействием солнечного излучения. Некоторые компоненты этого излучения губительны для живых организмов и растений на нашей планете, а озоновый слой поглощает их. Если бы не было озонового слоя, то жизнь на Земле постепенно бы прекратилась.
Многие ученые считают, что вещества, образующиеся в процессе производственной деятельности человека, разрушают озоновый слой. Это прежде всего фреоны — соединения, использующиеся в холодильных установках и дезодорантах, выбросы реактивных самолетов и ракет. Попадая в озоновый слой, эти вещества приводят к уменьшению его толщины или даже разрыву этого слоя — образованию так называемых озоновых дыр. В результате образования и увеличения размеров озоновых дыр могут наступить серьезные экологические катастрофы.
Применение кислорода
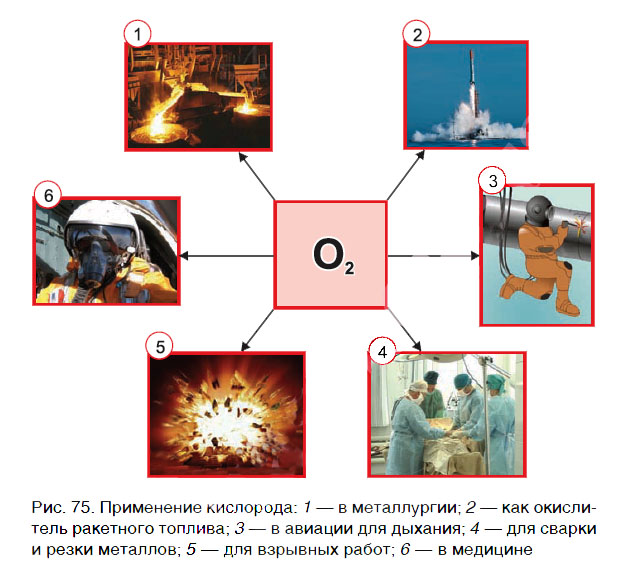
Кислород очень широко применяется в народном хозяйстве. На рисунке 75 приведены основные области применения кислорода. Главными потребителями кислорода являются металлургическая промышленность (выплавка стали), космическая техника (окислитель ракетного топлива), процессы обработки металлов (сварка и резка металлов).
Краткие выводы урока:
- Химический элемент кислород образует два простых вещества — кислород О2 и озон О3.
- Когда говорят о кислороде как о химическом элементе, подразумевают атомы кислорода О.
- Когда говорят о кислороде как о простом веществе, подразумевают вещество, состоящее из молекул и имеющее формулу О2.
Надеюсь урок 16 «Кислород и озон» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.