Урок 14. Расчеты по уравнениям химических реакций
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
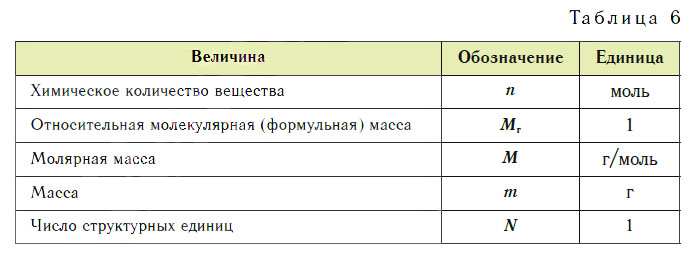
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо массой 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Пример 2. Определите массу алюминия, прореагировавшего с кислородом, если в результате реакции образовалось вещество Al2O3 химическим количеством 3,5 моль.
Пример 3. Рассчитайте объем (н. у.) кислорода, необходимого для полного сгорания фосфора массой 93 г.
Надеюсь урок 14 «Расчеты по уравнениям химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Химические реакции».