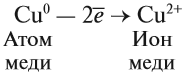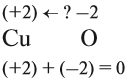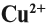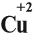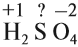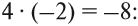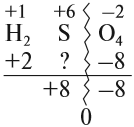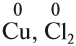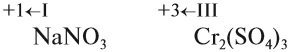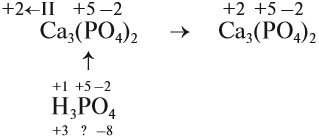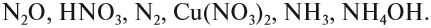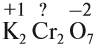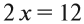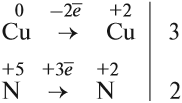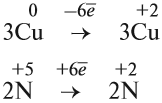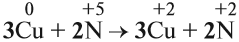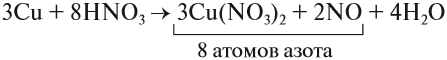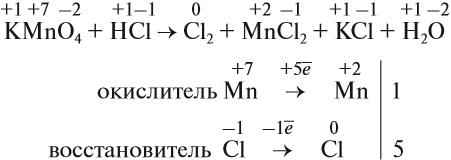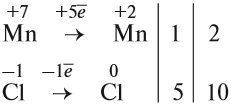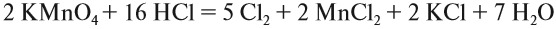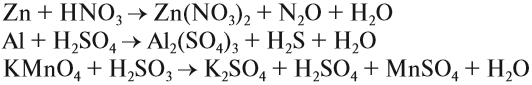Урок 7. Понятие об окислительно-восстановительных реакциях

При изучении строения атома, описании свойств некоторых элементов, химической связи неоднократно упоминалось о том, что атомы принимают или отдают электроны. Очевидно, существуют химические реакции, в ходе которых одни атомы отдают электроны другим атомам, которые их принимают.
Процесс отдачи электронов называется окислением, а процесс приёма электронов — восстановлением. Оба процесса происходят одновременно, так как не могут отданные электроны исчезнуть в «никуда» — должна существовать частица, которая их присоединит, и наоборот. Поэтому процессы окисления и восстановления, протекающие одновременно, называются окислительно-восстановительными реакциями. При этом атом*, отдающий электроны, называется восстановителем, а атом, принимающий электроны, — окислителем.
* В окислительно-восстановительной реакции участвует реальная частица, входящая в понятие химического элемента, — атом, ион, радикал.
Что же происходит с такими атомами? Пусть атом меди в каком-то процессе отдаст два электрона:
Если эта реакция происходит в растворе, то можно увидеть, как жёлто-красный металл медь уменьшится в размерах, а раствор приобретает голубую окраску, характерную для ионов меди. Очевидно, что свойства исходного простого вещества, состоящего из атомов, и полученных ионов — различно.
Этот же процесс может происходить и при окислении меди кислородом:
Но ионов здесь не образуется, хотя признак реакции (изменение цвета) налицо. В таких случаях изменение состояния окисленности обозначают при помощи степени окисления. Так, атому кислорода, который для завершения внешнего энергетического (электронного) уровня должен присоединить 2 электрона, почти во всех соединениях приписывают степень окисления –2. Поскольку молекула СuО электронейтральна — атом меди приобретает степень окисления +2.
Заметьте: заряд иона записывается так:
сбоку, сначала число, потом заряд (причём цифра 1 не пишется). Степень окисления записывают по-другому:
над символом элемента, сначала заряд, потом число (причём не только пишется цифра 1, но может быть даже дробное число).
Этой формой записи подчеркивают различие этих понятий:
- заряд иона — реальный заряд реальной, устойчивой частицы, которая входит в состав твёрдых веществ, определяет свойства некоторых растворов и т. д.;
- степень окисления — условный заряд воображаемого иона; этот заряд рассчитывается, исходя из предположения, что вещество состоит только из ионов (а это чаще всего не так). Степень окисления можно определить, исходя из строения атома данного химического элемента.
Величины этих зарядов могут совпадать, но очень часто они различаются. Рассчитаем, например, степени окисления элементов в химической формуле, соответствующей серной кислоте. При этом степень окисления кислорода равна –2, а водорода +1 (так как он может отдать только один электрон):
Суммарный заряд двух атомов водорода равен +2, а четырёх атомов кислорода:
суммарный заряд:
Видно, что для того, чтобы молекула была электронейтральна, не хватает положительных зарядов, следовательно, степень окисления серы в серной кислоте равна +6. (Такого иона серы вообще не существует!)
При расчёте степеней окисления следует руководствоваться следующими правилами:
1. Степень окисления атомов химических элементов в простом веществе равна нулю:
2. Степени окисления атомов металлов в соединениях всегда положительны и равны их валентности:
3. Степени окисления постоянны у F: –1; у Н: +1 (кроме гидридов — Li+1H-1); у О: –2 (кроме Н2+1 О2–1 , F2–1О+2 ).
4. Степень окисления химических элементов в кислотном остатке соли такие же, как в соответствующей кислоте:
5. Алгебраическая сумма степеней окисления в любом соединении равна нулю.
Задание 7.1. Расставьте степени окисления химических элементов в соединениях:
Если вы испытываете затруднения при расстановке степеней окисления, рекомендуется составлять простейшие математические уравнения.
Известные степени окисления
Суммарные степени окисления: +2 + 2х –14 = 0 (математическое уравнение, которое решается относительно «х»)
х = 6, т. е. степень окисления атома хрома в этом соединении равна +6.
Определив степени окисления элементов в уравнении реакции, можно определить, какой атом является окислителем, какой — восстановителем:
Задание 7.2. Определите окислитель и восстановитель в уравнениях реакций:
Из этих примеров видно, что число электронов, принятых окислителем, может отличаться от числа электронов, отданных восстановителем. Но этого быть не должно(!), так как при этом нарушается закон сохранения материи. Значит, число отданных электронов должно равняться числу принятых электронов. А для этого следует изменить число атомов окислителя и восстановителя, поставив соответствующие коэффициенты. Например, в данном случае:
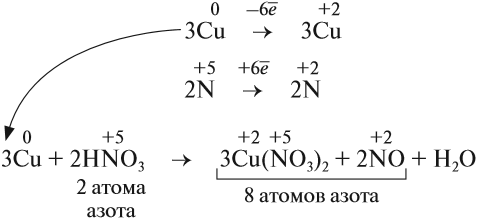
Эти коэффициенты (3 и 2) означают, что три атома меди отдают шесть электронов, а два атома азота принимают шесть электронов:
Или в краткой форме:
Теперь осуществлён баланс (равенство) электронов, поэтому именно эти коэффициенты из электронного баланса (3 и 2) должны быть в уравнении реакции
Но теперь не осуществляется баланс по азоту! Где же допущена ошибка? Дело в том, что в электронном балансе учитываются только электронные процессы окисления и восстановления, т. е. учитываются только те атомы, которые меняют степени окисления, а часть атомов не изменила ее:
Отсюда правило: коэффициенты электронного баланса ставят только к тем атомам, которые с данной степенью окисления встречаются в химическом уравнении один раз.
Исправим ошибку и уравняем атомы остальных элементов:
Проверим по кислороду:
- до реакции: 8 · 3 = 24 атома;
- после реакции: 3 · 3 · 2 + 2 + 4 = 24 атома.
Правила расстановки коэффициентов методом электронного баланса
1. Расставить степени окисления.
2. Выписать элементы, изменившие степени окисления, указав число отданных и принятых электронов. Определить окислитель и восстановитель.
3. Поставить дополнительные коэффициенты, уравняв число отданных и принятых электронов.
4. Проверить эти коэффициенты: они должны соответствовать числу атомов данного элемента в молекуле. Например, если дополнительный коэффициент нечётный, а в молекуле чётное число атомов (например, Сl2), то оба дополнительных коэффициента удваиваются.
5. Проверенные коэффициенты переносят в уравнение, считая атомы, к тем элементам, которые с данной степенью окисления встречаются в уравнении ОДИН раз.
6. Затем уравнивают атомы:
- металлов;
- неметаллов;
- водорода.
7. Проверяют по кислороду.
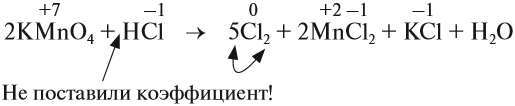
Рассмотрим эти правила на примере. Требуется уравнять (т. е. расставить коэффициенты в уравнении реакции):
1, 2, 3.
4. Поскольку число атомов хлора в молекуле чётное (2), а коэффициент к хлору нечётный (5), удвоим оба дополнительных коэффициента:
5. Переносим коэффициенты к атомам марганца и хлора, кроме Сl–1 , которые встречаются в уравнении реакции три раза:
Обратите внимание, что перед молекулой хлора поставлен коэффициент 5, а не 10, так как нужно считать атомы хлора: 5 · 2 = 10 атомов.
6. Уравняем остальные атомы:
7. Атомы кислорода до и после реакции пересчитайте сами.
Задание 7.3. Уравнять методом электронного баланса:
Вы можете проверить степень усвоения материала этой главы, выполнив упражнения ЕГЭ из разделов 4, 28 и частично 36.

Выводы
Окислительно-восстановительные реакции (ОВР) — это процессы, в которых изменяются степени окисления атомов. Степени окисления атомов изменяются потому, что один атом (окислитель) принимает электрон от атома восстановителя. При этом число принятых и отданных электронов должно быть одинаковым. На этом основан метод электронного баланса, при помощи которого расставляют коэффициенты в уравнениях ОВР.