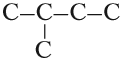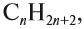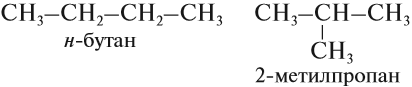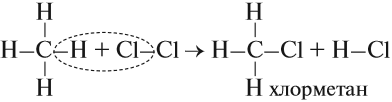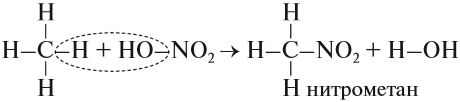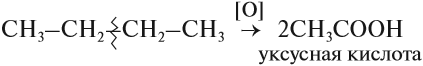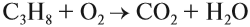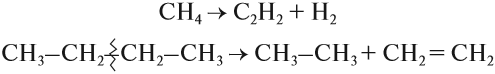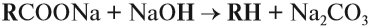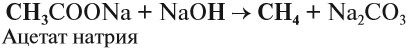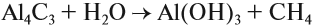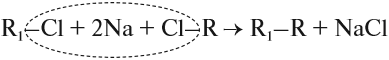Урок 18. Алканы

Содержание
Понятие об алканах
Алканы — это углеводороды незамкнутого (нециклического) строения, в молекулах которых атомы углерода соединены только простыми связями. Например:
Задание 18.1. Допишите атомы водорода и попробуйте ответить на вопрос: существует ли углеводород, имеющий большее число атомов водорода в молекуле?
Поэтому-то алканы обычно называют предельными углеводородами, то есть содержащими максимально возможное (предельное) число атомов водорода в молекуле.

Гомологический ряд, номенклатура, изомерия
Алканы образуют гомологический ряд с общей формулой
где n — число атомов углерода в молекуле. Если
- n = 1 → СН4, это метан;
- n = 2 → С2Н6, это этан;
- n = 3 → С3Н8, или СН3–СН2–СН3, это пропан.
Начиная с n = 4 для алканов возможна изомерия, то есть для вещества состава C4H10 существуют два соединения различного строения, а значит, различные по свойствам:
Следующий гомолог с n = 5 имеет уже три изомера, один из них н-пентан, то есть пентан нормального (неразветвлённого) строения.
Задание 18.2. Составьте графические формулы всех изомеров пентана (их три). Назовите эти изомеры.

Строение молекул
Атомы углерода и водорода в молекулах алканов соединены только простыми связями. Это ковалентные, слабо полярные связи.
Все С–Н связи в молекуле метана равноценны и направлены в пространстве к вершинам тетраэдра. Это σ-связи (сигма-связи), очень прочные. Поэтому метан и другие алканы с трудом вступают в химические реакции (на разрыв σ-связей нужно затратить много энергии). Все химические реакции алканов идут в особых условиях (нагревание, присутствие катализатора, освещение и др.), то есть при обычных условиях реакции алканов невозможны.

Свойства алканов
Физические свойства
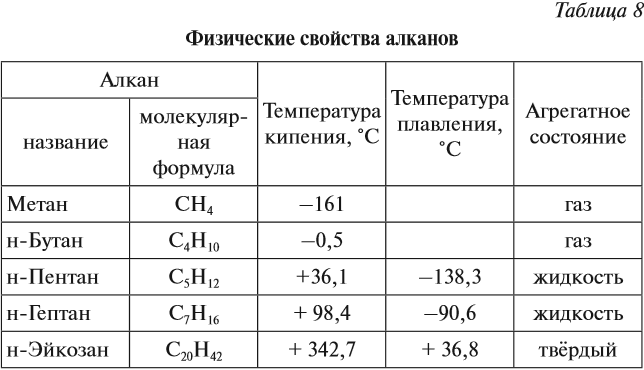
Поскольку все связи в молекулах алканов слабо полярны, то в молекулах отсутствуют какие-либо значительные заряды. Поэтому молекулы алканов слабо притягиваются друг к другу. В результате все алканы — это либо газы, либо летучие жидкости, либо твёрдые легкоплавкие вещества (табл. 8).
Смесь газообразных углеводородов образует природный газ. Начиная с n = 16, алканы являются твёрдыми веществами. Очищенные твёрдые предельные углеводороды называют парафином.
Неполярные углеводороды практически нерастворимы в полярном растворителе, например в воде, но прекрасно растворяются в неполярных растворителях. Таким растворителем является смесь жидких алканов (бензин, керосин). Природная смесь твёрдых, жидких и газообразных углеводородов называется нефтью. Нефть в основном состоит из алканов и циклоалканов. При переработке нефти получают: попутный нефтяной газ, смесь жидких алканов (бензин, керосин), твёрдых алканов (асфальт, парафин) и другие нефтепродукты. Такой способ переработки нефти называется нефтеперегонкой и осуществляется при её нагревании в специальных ректификационных колоннах.
Задание 18.3. Бензин представляет собой смесь алканов с числом атомов углерода от 5 до 9. Составьте их молекулярные формулы.
Химические свойства
Алканы, в принципе, не способны к реакциям присоединения, так как имеют максимально возможное число атомов водорода. Поэтому их называют насыщенными углеводородами.
Для алканов наиболее характерна реакция замещения. В результате такой реакции происходит замещение одного атома водорода алкана на новую группу или на атом (на каждой стадии). Характер химической связи при этом не изменяется.
К таким реакциям относятся:
- Реакция хлорирования, которая происходит под действием солнечного света:
- Реакция нитрования, которая происходит при нагревании:
Обратите внимание: молекулу азотной кислоты в органических реакциях рекомендуется записывать как НО–NO2, так как в результате реакций с ней в молекуле исходного вещества появляется нитрогруппа –NО2.
Для алканов возможны реакции окисления. В растворе они не происходят. Но в присутствии катализаторов алканы окисляются до кислот:
Обратите внимание! Знак [О] означает, что происходит неполное (мягкое) окисление. Окислителями могут быть разные вещества, не только кислород, например, перманганат калия KMnO4.
При полном окислении (горении) любой алкан (и любой углеводород!) превращается в углекислый газ и воду:
Газообразные алканы горят бесцветным пламенем, т. е. сгорают полностью! При этом выделяется много теплоты, поэтому алканы применяются в качестве топлива: природный газ, бензин, керосин, мазут и т. д.
Задание 18.4. Расставьте коэффициенты в уравнении реакции горения.
При нагревании до очень высоких температур в отсутствии кислорода происходит разрушение (крекинг) молекулы углеводорода:
При этом образуются и непредельные углеводороды.
Задание 18.5. Укажите формулы непредельных углеводородов.
Процессы крекинга используют при переработке нефти.
Задание 18.6. Напишите уравнения реакций:
- хлорирования этана;
- нитрования метана;
- горения пентана.

Получение и применение алканов
Алканы широко распространены в природе. Простейший алкан — метан — образуется в результате разложения без доступа воздуха остатков растительных и животных организмов, этот газ выделяется на болотах, поэтому он так и называется: «болотный газ». Метан накапливается в шахтах, где добывают каменный уголь, из-за этого на шахтах иногда бывают взрывы, так как смесь метана с воздухом взрывоопасна. Это следует учитывать и в быту, так как природный газ является источником тепла в газовых плитах. Метан составляет 95–97 % природного газа.
Алканы — ценное сырьё для получения смазочных масел, пластмасс, красок, стиральных порошков и т. д. Смеси алканов — бензин, керосин — топливо для автомобилей, тракторов, ракет, самолётов. Поэтому их получают в больших количествах в основном при переработке нефти и газа.
В лаборатории в небольших количествах алканы можно получить нагреванием соли карбоновой кислоты со щёлочью:
Внимание! Здесь и далее буквой R обозначается любой углеводородный радикал.
Так, метан получают нагреванием ацетата натрия в присутствии щёлочи:
Метан можно получить гидролизом карбида алюминия (см. урок 13.1):
Кроме того, в лаборатории алканы получают синтезом Вюрца из галогенпроизводных под действием натрия:
где R и R1 — предельные радикалы.

Выводы
Алканы — предельные, насыщенные углеводороды, в молекулах которых имеется максимально возможное (предельное) числа атомов углерода. Поэтому состав всех алканов СnH2n+2 и они не способны вступать в реакции присоединения. Все связи в молекулах алканов — неполярные, простые, очень прочные, поэтому алканы с трудом вступают в химические реакции. Это реакции замещения, крекинга, горения и каталитического окисления.