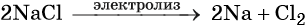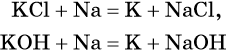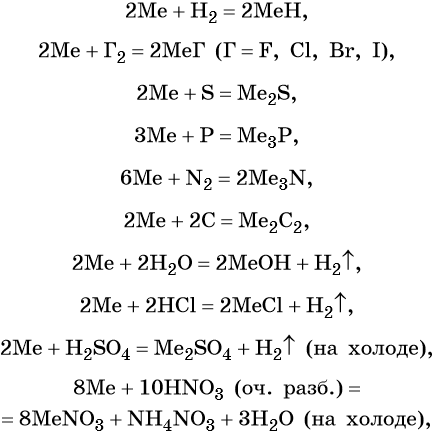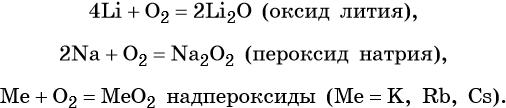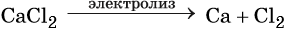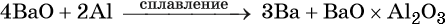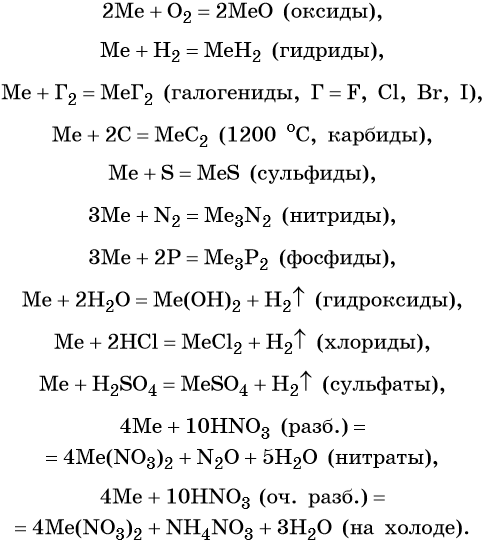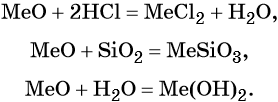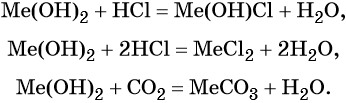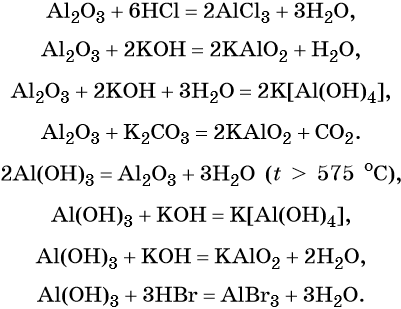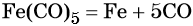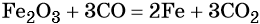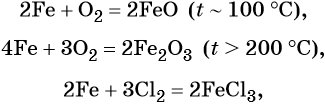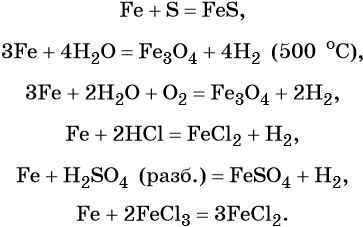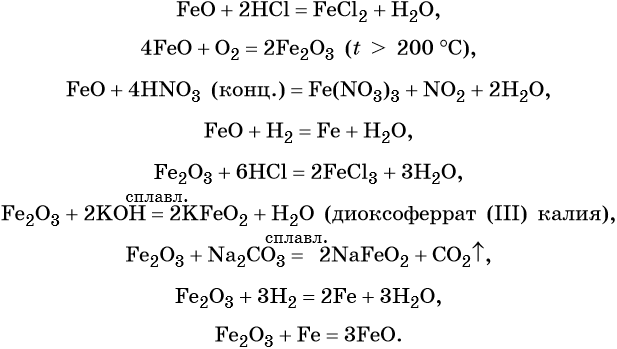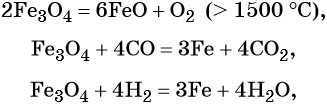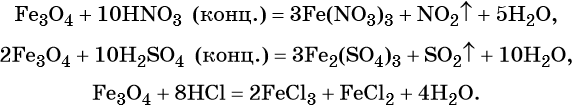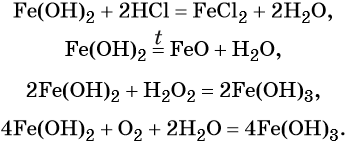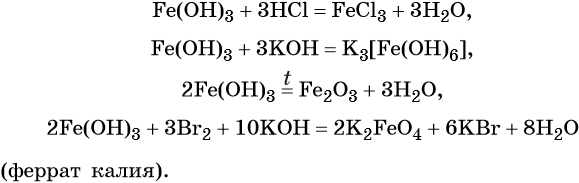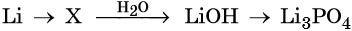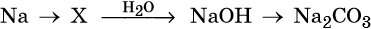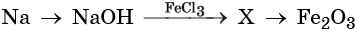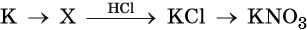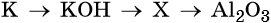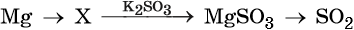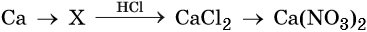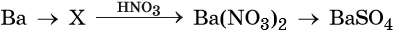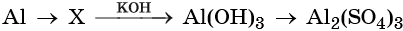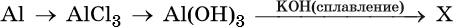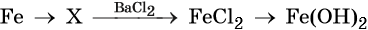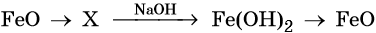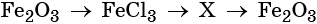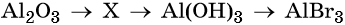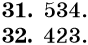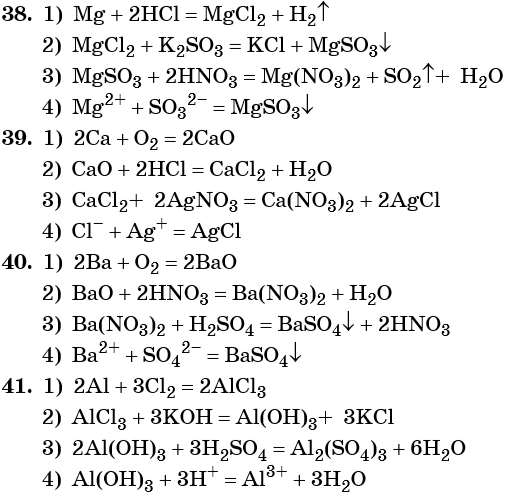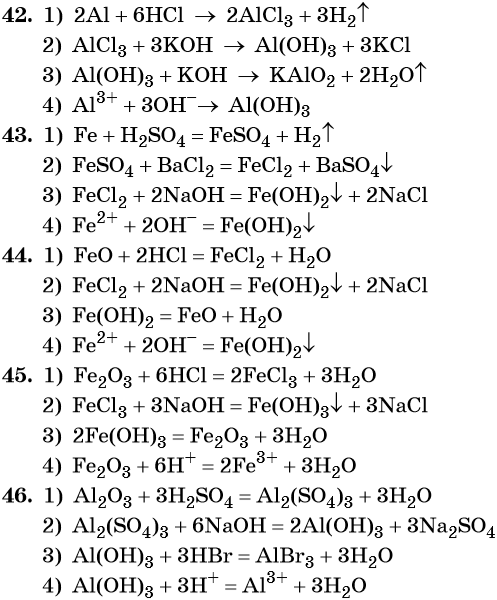Химические свойства простых веществ-металлов: щелочных и щелочноземельных металлов, алюминия, железа

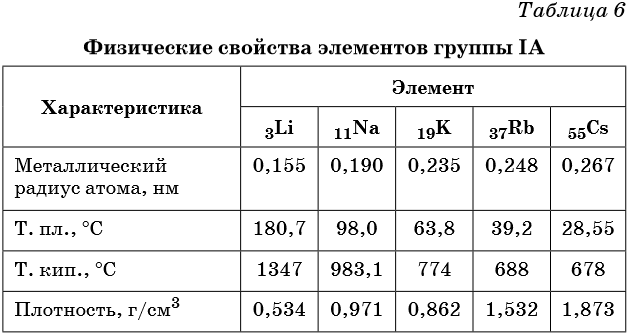
Элементами группы IA являются литий, натрий, калий, рубидий, цезий и франций. Их называют также щелочными металлами. Некоторые их физические свойства приведены в таблице 6.
Для щелочных металлов наблюдается общая для периодической системы закономерность: с увеличением порядкового номера возрастает радиус атома элемента и его металлические свойства, электроотрицательность уменьшается.
Общий способ получения щелочных металлов — электролиз расплавов их хлоридов, например:
Калий получают также с помощью натрийтермического метода:
Щелочные металлы химически очень активны, легко реагируют с простыми и сложными веществами, в своих соединениях проявляют степень окисления +1. Хранят щелочные металлы в герметичной таре под слоем обезвоженного керосина, а литий — под слоем вазелина.
Ниже представлены общие для всех щелочных металлов реакции (Me = Li, Na, K, Rb, Cs):
Исключением является реакция с кислородом, в которой щелочные металлы ведут себя по-разному:
Оксиды щелочных металлов Э2O являются типичными основными оксидами, а гидроксиды ЭОН — сильными основаниями (щелочами), сила которых возрастает от лития к цезию.
Элементами IIА-группы являются бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra. Последние три называют элементами подгруппы кальция или щёлочноземельными металлами. Некоторые свойства элементов IIА-группы приведены в таблице 7.
Свойства бериллия и магния несколько отличаются от свойств, характерных для щёлочноземельных металлов. Бериллий по многим свойствам близок к алюминию, а магний — к цинку (диагональное сходство).
Для щёлочноземельных металлов наблюдается общая для периодической системы закономерность: с увеличением порядкового номера возрастает радиус атома элемента и его металлические свойства, электроотрицательность уменьшается.
Магний и кальций получают электролизом расплавов их хлоридов, например:
Стронций и барий получают восстановлением их оксидов алюминием или кремнием, например:
Щёлочноземельные металлы химически активны; они легко реагируют с простыми и сложными веществами, в своих соединениях проявляют степень окисления +2.
Ниже приведены характерные для щёлочноземельных металлов реакции с простыми и сложными веществами (Me = Ca, Sr, Ba):
Оксиды щёлочноземельных металлов представляют собой типичные основные оксиды. Они реагируют с кислотами с образованием солей и воды, с кислотными оксидами с образованием солей. Реакция с водой протекает по-разному. Если оксид бария легко реагирует с водой при комнатной температуре с образованием сильной щёлочи Ba(OH)2, то оксид магния может реагировать с водой только при кипячении. Химические свойства оксидов щёлочноземельных металлов (Me = Ca, Sr, Ba):
Гидроксиды щёлочноземельных металлов проявляют основные свойства: реагируют с кислотами с образованием основных или средних солей и воды, с кислотными оксидами с образованием солей и воды. Химические свойства гидроксидов щёлочноземельных металлов (Me = Ca, Sr, Ba):
Сила оснований увеличивается с увеличением порядкового номера элемента.
Алюминий — химический элемент, расположенный в 3-м периоде IIIA группе. Его электронная формула 1s22s22p63s23p1.
Алюминий пассивируется в воде, концентрированной азотной кислоте из-за образования устойчивой оксидной пленки. Сильный восстановитель.
Химические свойства:
Оксид алюминия — типичный амфотерный оксид, гидроксид алюминия — типичный амфотерный гидроксид.
Железо находится в 4-м периоде VIIIБ группе. Его электронная формула 1s22s22p63s23p63d64s2. Металл средней активности, в своих соединениях проявляет степени окисления +2 и +3. Известны ряд соединений железа со степенью окисления +6.
Химически чистое железо получают разложением его пентакарбонила:
Основная масса железа используется не в чистом виде, а в виде сплавов с углеродом (сталь, чугун) и другими элементами. Эти сплавы получают в доменных печах.
Упрощённо этот процесс можно описать уравнением:
Характерные для железа химические реакции:
FeO проявляет основные, а Fe2O3 — амфотерные с преобладанием основных свойства. Оба оксида вступают в окислительно-восстановительные реакции.
Для двойного оксида железа (II) — железа (III) Fe3O4 (магнетит) характерны в первую очередь окислительно-восстановительные реакции, а также реакции обмена, которые идут так же, как и у входящих индивидуально в его состав оксидов:
Гидроксид железа (II) практически проявляет только основные свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
Гидроксид железа (III) проявляет амфотерные с преобладанием основных свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
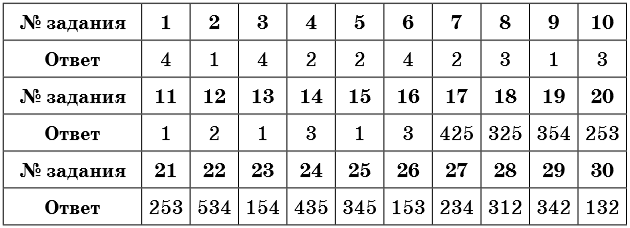
Тренировочные задания
1. Литий при соответствующих условиях вступает в реакцию с каждым из двух веществ
1) кислородом и алюминием
2) серой и хромом
3) оксидом углерода (II) и оксидом меди (I)
4) азотом и фосфором
2. Верны ли следующие утверждения о литии?
А. Литий хранят под слоем вазелина. Б. Взаимодействие лития с кислородом приводит к пероксиду лития.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
3. Натрий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) ртутью и алюминием
2) фосфором и оксидом кальция
3) оксидом серы (IV) и оксидом кальция
4) азотной кислотой и водой
4. Верны ли следующие утверждения о натрии?
А. Натрий не реагирует с фосфором даже при нагревании.
Б. Натрий используют в технике при получении калия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
5. Калий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) водой и магнием
2) серой и разбавленной серной кислотой
3) оксидом фосфора (V) и оксидом магния
4) азотной кислотой и оксидом серы (VI)
6. Верны ли следующие утверждения о калии?
А. Калий не реагирует с водой.
Б. Гидрид калия нельзя получить прямой реакцией калия с водородом.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
7. Магний при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) в одой и железом
2) серой и разбавленной серной кислотой
3) оксидом фосфора (V) и оксидом кремния
4) азотной кислотой и оксидом серы (VI)
8. Верны ли следующие утверждения о магнии?
А. Магний на воздухе покрывается оксидной пленкой.
Б. Магний реагирует с соляной кислотой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
9. Кальций при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) водой и углеродом
2) фосфором и литием
3) оксидом фосфора (V) и оксидом азота (IV)
4) оксидом бария и оксидом серы (VI)
10. Верны ли следующие утверждения о кальции?
А. Кальций реагирует с азотом при нагревании.
Б. Кальций не реагирует с оксидом фосфора (V).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
11. Барий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) водой и соляной кислотой
2) фосфором и натрием
3) оксидом фосфора (V) и оксидом лития
4) оксидом углерода (IV) и оксидом серы (VI)
12. Верны ли следующие утверждения о барии?
А. Барий не вступает в реакцию с бромом.
Б. Барий вступает в реакцию с водой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
13. Алюминий при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) серой и соляной кислотой
2) фосфором и оксидом калия
3) оксидом фосфора (V) и водой
4) железом и оксидом серы (VI)
14. Верны ли следующие утверждения об алюминии?
А. Алюминий вступает в реакцию с Fe2O3.
Б. Алюминий реагирует с соляной кислотой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
15. Железо при соответствующих условиях вступает в реакцию с каждым из двух веществ:
1) серой и соляной кислотой
2) фосфором и оксидом калия
3) оксидом фосфора (V) и водой
4) кислородом и оксидом серы (VI)
16. Верны ли следующие утверждения о железе?
А. Железо вступает в реакцию с Fe2O3.
Б. Железо реагирует с соляной кислотой.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
17. Установите соответствие между реагирующими веществами и продуктами реакции
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Li + HNO3 (разб.) →
Б) Li + S →
В) Li + H2O →
ПРОДУКТЫ РЕАКЦИИ
1) LiNO3 + H2↑
2) Li2S
3) LiOH
4) LiNO3 + NH4NO3 + H2O
5) LiOH + H2
18. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Li + O2 →
Б) Li + Cl2 →
В) Li + HNO3 (разб.) →
ПРОДУКТЫ РЕАКЦИИ
1) LiNO3 + H2↑
2) LiCl
3) Li2O
4) Li2O2
5) LiNO3 + NH4NO3 + H2O
19. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na + O2 →
Б) Na + H2SO4 →
В) Na + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) NaCl
2) Na2O
3) Na2O2
4) NaCl + H2↑
5) Na2SO4 + H2↑
20. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Na + HNO3 (разб.) →
Б) Na + O2 →
В) Na + H2O →
ПРОДУКТЫ РЕАКЦИИ
1) NaNO3 + H2↑
2) NaNO3 + NH4NO3 + H2O
3) NaOH + H2↑
4) Na2O
5) Na2O2
21. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) K + O2 →
Б) K + HCl →
В) K + S →
ПРОДУКТЫ РЕАКЦИИ
1) K2O
2) KO2
3) K2S
4) KCl + H2O
5) KCl + H2↑
22. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) K + H2O →
Б) K + Cl2 →
В) K + H2SO4 (разб.) →
ПРОДУКТЫ РЕАКЦИИ
1) KH + O2
2) K2SO4
3) KCl
4) K2SO4 + H2↑
5) KOH + H2↑
23. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Mg + HNO3 (разб.) →
Б) Mg + N2 →
В) Mg + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) Mg(NO3)2 + N2O + H2O
2) Mg(NO3)2 + H2↑
3) MgO + H2↑
4) MgCl2 + H2↑
5) Mg3N2
24. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Mg + H2SO4 (разб.) →
Б) Mg + H2 →
В) Mg + HNO3 →
ПРОДУКТЫ РЕАКЦИИ
1) MgSO4 + SO2 + H2O
2) Mg(NO3)2 + H2↑
3) MgH2
4) MgSO4 + H2↑
5) Mg(NO3)2 + N2O + H2O
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ca + HNO3 (разб.) →
Б) Ca + P →
В) Ca + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) Ca(NO3)2 + NO2 + H2O
2) CaCl2 + H2O
3) Ca(NO3)2 + N2O + H2O
4) Ca3P2
5) CaCl2 + H2↑
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ca + N2 →
Б) Ca + C →
В) Ca + HCl →
ПРОДУКТЫ РЕАКЦИИ
1) Ca3N2
2) Ca2C
3) CaCl2
4) CaCl2 + H2↑
5) CaC2
27. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ba + HNO3 (разб.) →
Б) Ba + H2 →
В) Ba + H2O →
ПРОДУКТЫ РЕАКЦИИ
1) Ba(NO3)2 + N2O3↑ + H2O
2) Ba(NO3)2 + N2O↑ + H2O
3) BaH2
4) Ba(OH)2 + H2↑
5) Ba(OH)2
28. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Ba + N2 →
Б) Ba + O2 →
В) Ba + C →
ПРОДУКТЫ РЕАКЦИИ
1) BaO
2) Ba2O2
3) Ba3N2
4) BaC2
5) Ba2C
29. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Al + HCl →
Б) Al + C →
В) Al + Fe2O3 →
ПРОДУКТЫ РЕАКЦИИ
1) FeAlO2
2) Al2O3 + Fe
3) AlCl3 + H2↑
4) Al4C3
5) Al2C3
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Al + NaOH + H2O →
Б) Al + P →
В) Al + HI →
ПРОДУКТЫ РЕАКЦИИ
1) Na[Al(OH)4] + H2↑
2) AlI3 + H2↑
3) AlP
4) Na[Al(OH)4]
5) Al(OH)3 + H2↑
31. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Fe + HCl →
Б) Fe + H2SO4 (разб.) →
В) Fe + S →
ПРОДУКТЫ РЕАКЦИИ
1) FeCl3 + H2↑
2) Fe2(SO4)3 + H2↑
3) FeSO4 + H2↑
4) FeS
5) FeCl2 + H2↑
32. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) Fe + H2O (пар) →
Б) Fe + HNO3 (разб.) →
В) Fe + CuSO4 →
ПРОДУКТЫ РЕАКЦИИ
1) Fe2(SO4)3 + Cu
2) Fe(NO3)3 + NO + H2O
3) FeSO4 + Cu
4) Fe3O4 + H2
5) Fe(NO3)3 + NO2 + H2O
33. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
35. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
37. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
38. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
39. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
40. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
41. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
42. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
43. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.