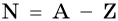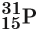Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева

Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. В центре атома находится положительно заряженное ядро. Оно занимает ничтожную часть пространства внутри атома, в нём сосредоточены весь положительный заряд и почти вся масса атома.
Ядро состоит из элементарных частиц — протона и нейтрона; вокруг атомного ядра по замкнутым орбиталям движутся электроны.
Протон (р) — элементарная частица с относительной массой 1,00728 атомной единицы массы и зарядом +1 условную единицу. Число протонов в атомном ядре равно порядковому номеру элемента в Периодической системе Д.И. Менделеева.
Нейтрон (n) — элементарная нейтральная частица с относительной массой 1,00866 атомной единицы массы (а. е. м.).
Число нейтронов в ядре N определяют по формуле:
где А — массовое число, Z — заряд ядра, равный числу протонов (порядковому номеру).
Обычно параметры ядра атома записывают следующим образом: слева внизу от символа элемента ставят заряд ядра, а вверху — массовое число, например:
Эта запись показывает, что заряд ядра (следовательно, и число протонов) для атома фосфора равен 15, массовое число равно 31, а число нейтронов равно 31 – 15 = 16. Так как массы протона и нейтрона очень мало отличаются друг от друга, то массовое число приблизительно равно относительной атомной массе ядра.
Электрон ( е–) — элементарная частица с массой 0,00055 а. е. м. и условным зарядом –1. Число электронов в атоме равно заряду ядра атома (порядковому номеру элемента в Периодической системе Д.И. Менделеева).
Электроны движутся вокруг ядра по строго определённым орбиталям, образуя так называемое электронное облако.
Область пространства вокруг атомного ядра, где наиболее (90 и более %) вероятно нахождение электрона, определяет форму электронного облака.
Электронное облако s-электрона имеет сферическую форму; на s-энергетическом подуровне может максимально находиться два электрона.
Электронное облако p-электрона имеет гантелеобразную форму; на трёх p-орбиталях максимально может находиться шесть электронов.
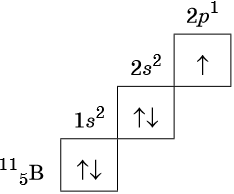
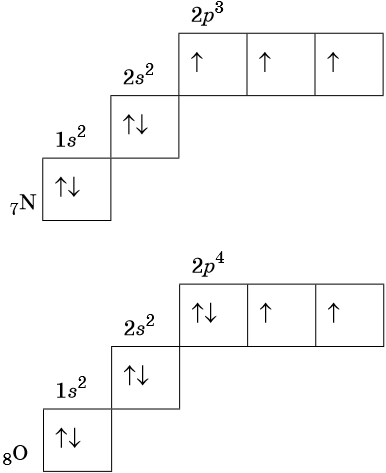
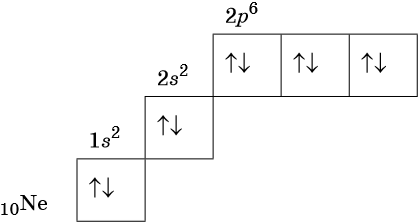
Орбитали изображают в виде квадрата, сверху или снизу которого пишут значения главного и побочного квантовых чисел, описывающих данную орбиталь. Такую запись называют графической электронной формулой, например:
В этой формуле стрелками обозначают электрон, а направление стрелки соответствует направлению спина — собственного магнитного момента электрона. Электроны с противоположными спинами ↑↓ называют спаренными.
Электронные конфигурации атомов элементов можно представить в виде электронных формул, в которых указывают символы подуровня, коэффициент перед символом подуровня показывает его принадлежность к данному уровню, а степень у символа — число электронов данного подуровня.
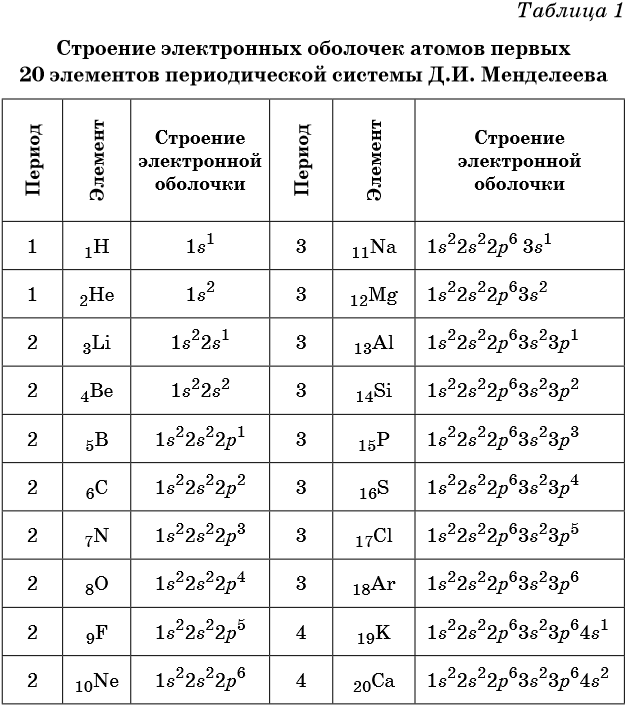
В таблице 1 приведено строение электронных оболочек атомов первых 20 элементов Периодической системы химических элементов Д.И. Менделеева.
Химические элементы, в атомах которых s-подуровень внешнего уровня пополняется одним или двумя электронами, называют s-элементами. Химические элементы, в атомах которых заполняется p-подуровень (от одного до шести электронов), называют p-элементами.
Число электронных слоёв в атоме химического элемента равно номеру периода.
В соответствии с правилом Хунда электроны располагаются на однотипных орбиталях одного энергетического уровня таким образом, чтобы суммарный спин был максимален. Следовательно, при заполнении энергетического подуровня каждый электрон прежде всего занимает отдельную ячейку, а только после этого начинается их спаривание. Например, у атома азота все p-электроны будут находиться в отдельных ячейках, а у кислорода начнётся их спаривание, которое полностью закончится у неона.
Изотопами называют атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов.
Изотопы известны для всех элементов. Поэтому атомные массы элементов в периодической системе являются средним значением из массовых чисел природных смесей изотопов и отличаются от целочисленных значений. Таким образом, атомная масса природной смеси изотопов не может служить главной характеристикой атома, а следовательно, и элемента. Такой характеристикой атома является заряд ядра, определяющий число электронов в электронной оболочке атома и её строение.
Рассмотрим несколько типовых заданий по этому разделу.
Пример 1. Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p64s1?
- Li
- Na
- K
- Cl
На внешнем энергетическом уровне у данного элемента находится один 4s-электрон. Следовательно, этот химический элемент находится в четвёртом периоде первой группе главной подгруппе. Этот элемент — калий.
К этому ответу можно прийти по-другому. Сложив общее количество всех электронов, получим 19. Общее число электронов равно порядковому номеру элемента. Под номером 19 в периодической системе находится калий.
Пример 2. Химическому элементу соответствует высший оксид RO2. Электронной конфигурации внешнего энергетического уровня атома этого элемента соответствует электронная формула:
- ns2np4
- ns2np2
- ns2np3
- ns2np6
По формуле высшего оксида (смотрите на формулы высших оксидов в Периодической системе) устанавливаем, что этот химический элемент находится в четвёртой группе главной подгруппы. У этих элементов на внешнем энергетическом уровне находятся четыре электрона — два s и два p. Следовательно, правильный ответ 2.
Тренировочные задания
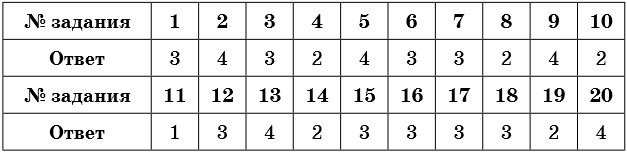
1. Общее число s-электронов в атоме кальция равно
1) 20
2) 40
3) 8
4) 6
2. Число спаренных p-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
3. Число неспаренных s-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
4. Число электронов на внешнем энергетическом уровне атома аргона равно
1) 18
2) 6
3) 4
4) 8
5. Число протонов, нейтронов и электронов в атоме 94Be равно
1) 9, 4, 5
2) 4, 5, 4
3) 4, 4, 5
4) 9, 5, 9
6. Распределение электронов по электронным слоям 2; 8; 4 — соответствует атому, расположенному в(во)
1) 3-м периоде, IА группе
2) 2-м периоде, IVА группе
3) 3-м периоде, IVА группе
4) 3-м периоде, VА группе
7. Химическому элементу, расположенному в 3-м периоде VA группе соответствует схема электронного строения атома
1) 2, 8, 6
2) 2, 6, 4
3) 2, 8, 5
4) 2, 8, 2
8. Химический элемент с электронной конфигурацией 1s22s22p4 образует летучее водородное соединение, формула которого
1) ЭН
2) ЭН2
3) ЭН3
4) ЭН4
9. Число электронных слоёв в атоме химического элемента равно
1) его порядковому номеру
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
10. Число внешних электронов в атомах химических элементов главных подгрупп равно
1) порядковому номеру элемента
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
11. Два электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) He, Be, Ba
2) Mg, Si, O
3) C, Mg, Ca
4) Ba, Sr, B
12. Химический элемент, электронная формула которого 1s22s22p63s23p64s1, образует оксид состава
1) Li2O
2) MgO
3) K2O
4) Na2O
13. Число электронных слоев и число p-электронов в атоме серы равно
1) 2, 6
2) 3, 4
3) 3, 16
4) 3, 10
14. Электронная конфигурация ns2np4 соответствует атому
1) хлора
2) серы
3) магния
4) кремния
15. Валентные электроны атома натрия в основном состоянии находятся на энергетическом подуровне
1) 2s
2) 2p
3) 3s
4) 3p
16. Атомы азота и фосфора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковую конфигурацию внешнего электронного слоя
4) одинаковое число электронов
17. Одинаковое число валентных электронов имеют атомы кальция и
1) калия
2) алюминия
3) бериллия
4) бора
18. Атомы углерода и фтора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковое число электронных слоёв
4) одинаковое число электронов
19. У атома углерода в основном состоянии число неспаренных электронов равно
1) 1
3) 3
2) 2
4) 4
20. В атоме кислорода в основном состоянии число спаренных электронов равно
1) 2
3) 4
2) 8
4) 6