Урок 8. Строение солей
В уроке 8 «Строение солей» из курса «Химия для чайников» выясним что такое соль, а также что из себя представляет кристаллическая решетка соли; рассмотрим как происходит плавление, кипение и испарение солей. Основы химии, которые необходимы для изучения строения солей, подробно изложены в предыдущих уроках: «простые ионы» и «комплексные ионы». Обязательно их просмотрите, если вы этого еще не сделали.
Что такое соль?
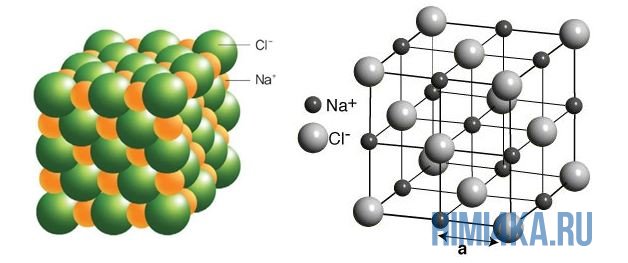
Соль — это химическое соединение из отрицательных и положительных ионов. Попробуем образовать соль из иона олова(II) Sn2+ с хлорид-иона Cl—. Поскольку любая соль должно быть электрически нейтральным соединением, то суммарный заряд всех ее положительных и отрицательных ионов должен быть равным нулю. Поэтому соль, состоящая из ионов Sn2+ и Cl—, должна иметь молекулярную формулу SnCl2, а не SnCl или SnCl3. Это соединение называется хлорид олова(II). В случае с четырехвалентным ионом олова Sn4+, соединение имело бы вид SnCl4. Все просто!
Строго говоря, нельзя употреблять термины «молекулярная формула и молекулярная масса» соли, поскольку в солях нет молекул, а имеются только упорядоченные решетки, состоящие из ионов. Ни один из ионов натрия в структуре хлорида натрия, не «принадлежит» какому-либо конкретному хлорид-иону. Правильно говорить о химической формуле соли и соответствующей ей формульной массе. Поскольку химическая формула хлорида натрия — NaCl, то его формульная масса определяется как сумма атомных масс одного атома натрия Na и одного атома хлора Cl:
1 атом натрия: 22,990 а.е.м.
1 атом хлора: 35,453 а.е.м.
Итого: 58,443 а.е.м
Принято называть эту величину «молекулярной массой» хлорида натрия, и не возникает никаких недоразумений, если ясно отдавать себе отчет, какую структуру имеет соль. Моль хлорида натрия имеет массу 58,443 г. В нем содержится 6,022·1023 ионов натрия и 6,022·1023 хлорид-ионов. Хотя они и не объединены попарно в молекулы, соотношение между числом тех и других ионов точно 1:1.
Кристалл соли представляет собой устойчивое образование из катионов и анионов, в котором ион каждого типа как можно дальше удален от других ионов с зарядом такого же знака.
Если к кристаллу соли подвести БОЛЬШОЕ количество энергии, то можно разрушить такое идеальное расположение ионов в кристаллической решетке соли и позволить взаимно отталкивающимся зарядам приблизиться друг к другу на некоторый промежуток времени, тем самым разрушив устойчивую структуру кристалла. Как мы уже отметили, сообщаемая кристаллу соли энергия должна быть достаточно большой, по этой причине плавление солей происходит при бОльших температурах, чем у молекулярных кристаллов (например, лед).
Плавление, кипение и испарение солей
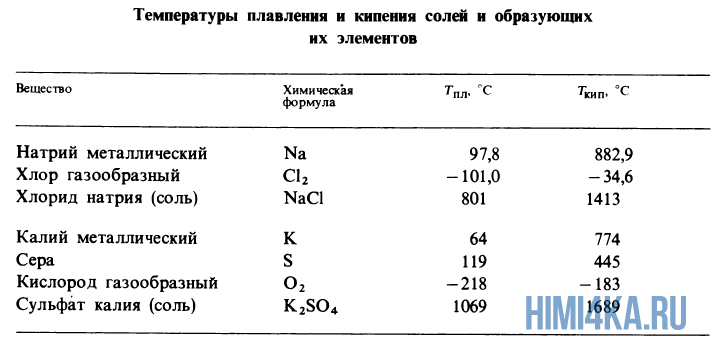
Ниже приведены температуры плавления и кипения солей, NaCl и K2SO4, а также их составляющих. Металлический натрий плавится при +97,8ºC, а кристаллический хлор имеет температуру плавления -101ºC, однако соль NaCl, которые они образуют, нужно нагреть до температуры плавления +801ºC.
Кипение и испарение соли происходит при еще гораздо больших температурах. В расплавленном кристалле соли ионы остаются такими же, но ведут себя как молекулы в жидкости, т.е свободно проскальзывают мимо друг друга. В случае когда соль переходит в газообразное состояние, положительные ионы Na+ и отрицательные ионы Cl— объединяются в нейтральные молекулы NaCl с полярной связью.
Надеюсь урок 8 «Строение солей» помог создать некоторое представление о солях. Если у вас возникли вопросы, пишите их в комментарии.