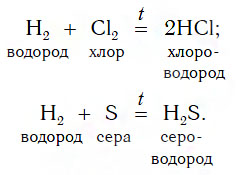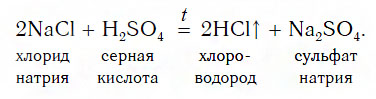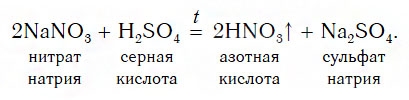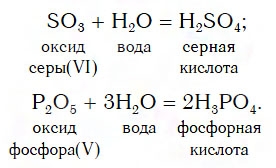Урок 36. Получение и применение кислот
В уроке 36 «Получение и применение кислот» из курса «Химия для чайников» изучим все возможные способы получения кислот в лабораторных условиях, а также узнаем о широком спектре применения серной кислоты.
Содержание
Получение кислот
Для получения неорганических кислот используют реакции разных типов. Рассмотрим важнейшие из них.
Взаимодействие некоторых простых веществне — металлов с водородом
Например:
Образующиеся газообразные продукты реакций — HCl и H2S — растворяют в воде и получают соответствующие бескислородные кислоты — хлороводородную и сероводородную. Таким же образом можно получить и бромоводородную кислоту — раствор газа бромоводорода HBr в воде. К какому типу относятся рассмотренные реакции получения HCl и H2S?
Взаимодействие серной кислоты с твердыми солями
Этот способ основан на том, что нелетучая серная кислота H2SO4 при нагревании вытесняет летучие кислоты — HCl и HNO3— из их солей. Поэтому хлороводородную кислоту можно получить, нагревая смесь ее соли — твердого хлорида натрия с серной кислотой:
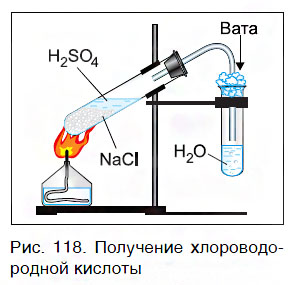
Газообразный хлороводород, выделяющийся в этой реакции, растворяют в воде и получают хлороводородную кислоту (рис. 118). Поскольку она образуется из хлорида натрия NaCl, называемого в быту просто «соль», то эту кислоту очень часто называют «соляной кислотой».
Для получения азотной кислоты нагревают смесь ее соли — нитрата натрия NaNO3 — с серной кислотой:
Пары азотной кислоты, образующиеся в результате этой реакции, охлаждают до комнатной температуры, и она переходит в жидкое состояние.
Взаимодействие кислотных оксидов с водой
Вы уже знаете, что кислотные оксиды, кроме SiO2, реагируют с водой. Это их свойство используют для получения некоторых кислородсодержащих кислот, например серной и фосфорной:
Поскольку оксид кремния SiO2 с водой не реагирует, то соответствующую ему кислоту H2SiO3 получают другими способами.
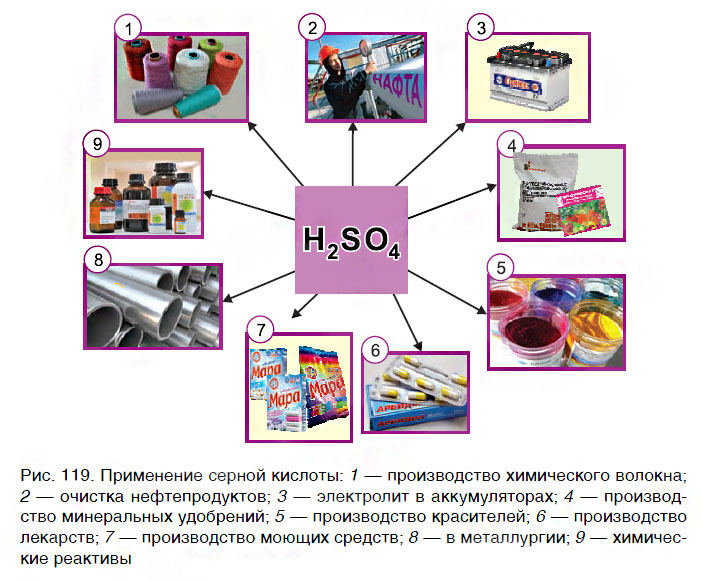
Применение кислот
Кислоты широко используются практически во всех сферах деятельности человека — в быту, в различных отраслях промышленности, в медицине. Наибольшее применение находит серная кислота (рис. 119). Так как кислоты оказывают разрушающее действие на кожу, бумагу, ткани, обращаться с ними следует осторожно, соблюдая правила безопасности.
Краткие выводы урока:
- Для получения кислот используют реакции: водорода с некоторыми простыми веществами (хлор и сера); кислотных оксидов с водой; солей с кислотами.
- Кислоты находят широкое применение в промышленности и в быту.
- Кислоты — едкие вещества, обращаться с которыми следует осторожно.
Надеюсь урок 36 «Получение и применение кислот» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.