Урок 25. Закон Бойля-Мариотта
В уроке 25 «Закон Бойля-Мариотта» из курса «Химия для чайников» рассмотрим закон, связывающий давление и объем газа, а также графики зависимости давления от объема и объема от давления. Напомню, что в прошлом уроке «Давление газа» мы рассмотрели устройство и принцип действия ртутного барометра, а также дали определение давлению и рассмотрели его единицы измерения.
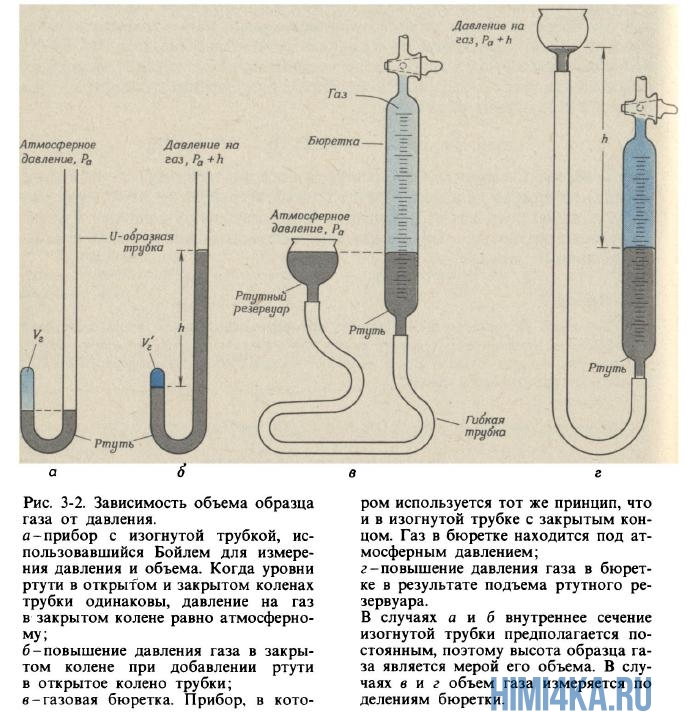
Роберт Бойль (1627-1691), которому мы обязаны первым практически правильным определением химического элемента (узнаем в гл. 6), интересовался также явлениями, происходящими в сосудах с разреженным воздухом. Изобретая вакуумные насосы для выкачивания воздуха из закрытых сосудов, он обратил внимание на свойство, знакомое каждому, кому случалось накачивать камеру футбольного мяча или осторожно сжимать воздушный шарик: чем сильнее сжимают воздух в закрытом сосуде, тем сильнее он сопротивляется сжатию. Бойль называл это свойство «пружинистостью» воздуха и измерял его при помощи простого устройства, показанного на рис. 3.2, а и б.
Бойль запирал ртутью немного воздуха в закрытом конце изогнутой трубки (рис. 3-2, а) а затем сжимал этот воздух, понемногу добавляя ртуть в открытый конец трубки (рис. 3-2, б). Давление, испытываемое воздухом в закрытой части трубки, равно сумме атмосферного давления и давления столбика ртути высотой h (h — высота, на которую уровень ртути в открытом конце трубки превышает уровень ртути в закрытом конце). Полученные Бойлем данные измерения давления и объема приведены в табл. 3-1. Хотя Бойль не предпринимал специальных мер для поддержания постоянной температуры газа, по-видимому, в его опытах она менялась лишь незначительно. Тем не менее Бойль заметил, что тепло от пламени свечи вызывало значительные изменения свойств воздуха.
Анализ данных о давлении и объеме воздуха при его сжатии
Таблица 3-1, которая содержит экспериментальные данные Бойля о взаимосвязи давления и объема для атмосферного воздуха, расположена под спойлером.
После того как исследователь получает данные, подобные приведенным в табл. 3-1, он пытается найти математическое уравнение, связывающее между собой две зависящие друг от друга величины, которые он измерял. Один из способов получения такого уравнения заключается в графическом построении зависимости различных степеней одной величины от другой в надежде получить прямолинейный график. Общее уравнение прямой линии имеет вид:
- y = ах + b (3-2)
где х и у — связанные между собой переменные, а a и b — постоянные числа. Если b равно нулю, прямая линия проходит через начало координат.
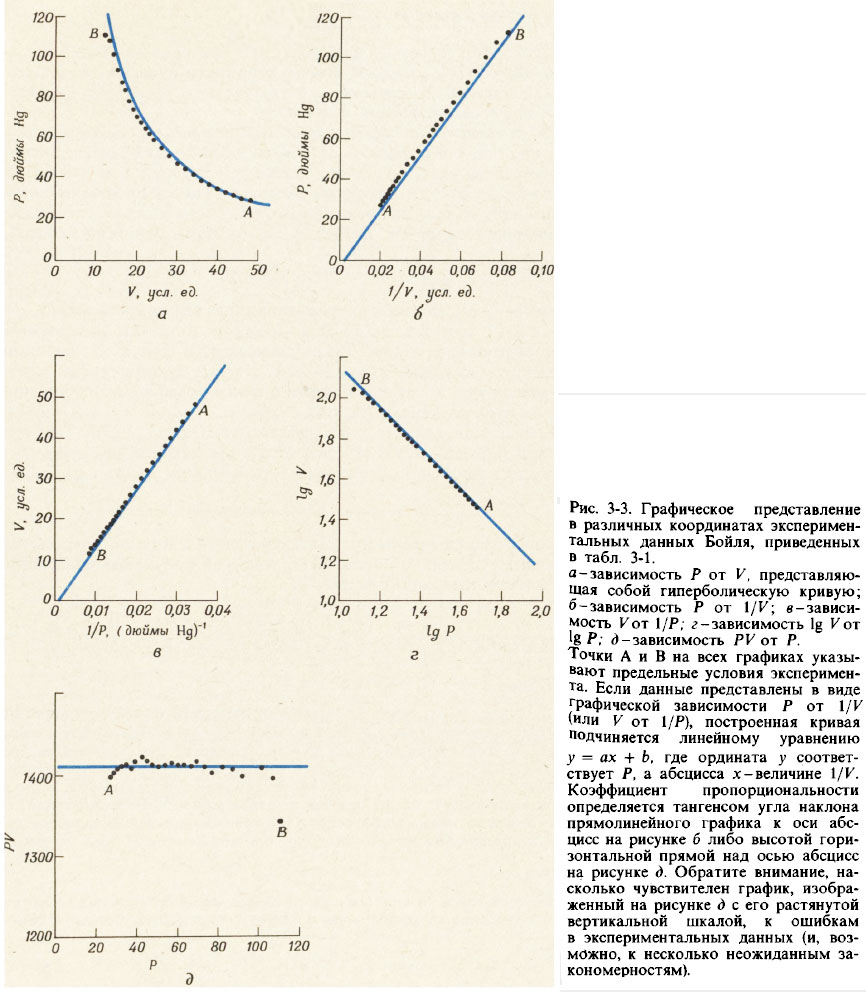
На рис. 3-3 показаны различные способы графического представления данных для давления Р и объема V, приведенных в табл. 3-1. Графики зависимости Р от 1/К и зависимости V от 1/Р представляют собой прямые линии, проходящие через начало координат. График зависимости логарифма Р от логарифма V также является прямой линией с отрицательным наклоном, тангенс угла которого равен — 1. Все эти три графика приводят к эквивалентным уравнениям:
- P = a / V (3-3а)
- V = a / P (3-3б)
и
- lg V = lg а — lg Р (3-3в)
Каждое из этих уравнений представляет собой один из вариантов закона Бойля-Мариотта, который обычно формулируется так: для заданного числа молей газа его давление пропорционально объему, при условии что температура газа остается постоянной.
Кстати, наверняка вам стало интересно, почему закон Бойля-Мариотта назван двойным именем. Это произошло так, потому что этот закон независимо от Роберта Бойля, который открыл его в 1662 году, был переоткрыт Эдмом Мариоттом в 1676 году. Вот так вот.
Когда взаимосвязь между двумя измеряемыми величинами проста до такой степени, как в данном случае, ее можно установить и численным способом. Если каждое значение давления Р умножить на соответствующее значение объема V, нетрудно убедиться, что все произведения для заданного образца газа при постоянной температуре оказываются приблизительно одинаковыми (см. табл. 3-1). Таким образом, можно записать, что
- P·V = а ≈ 1410 (3-3г)
Уравнение (З-Зг) описывает гиперболическую зависимость между величинами Р и V (см. рис. 3-3,а). Для проверки того, что построенный по экспериментальным данным график зависимости Р от V действительно соответствует гиперболе, построим еще дополнительный график зависимости произведения P·V от Р и убедимся, что он представляет собой горизонтальную прямую линию (см. рис. 3-3,д).
Бойль установил, что для заданного количества любого газа при постоянной температуре взаимосвязь между давлением Р и объемом V вполне удовлетворительно описывается соотношением
- P·V = const (при постоянных Т и n) (3-4)
Формула из закона Бойля-Мариотта
Для сопоставления объемов и давлений одного и того же образца газа при различных условиях (но постоянной температуре) удобно представить закон Бойля-Мариотта в следующей формуле:
- P1·V1 = Р2·V2 (3-5)
где индексы 1 и 2 соответствуют двум различным условиям.
Пример 4. Доставляемые на плато Колорадо пластмассовые мешочки с пищевыми продуктами (см. пример 3) часто лопаются, потому что воздух, находящийся в них, при подъеме от уровня моря на высоту 2500 м, в условиях пониженного атмосферного давления, расширяется. Если предположить, что внутри мешочка при атмосферном давлении, соответствующем уровню моря, заключено 100 см3 воздуха, какой объем должен занимать этот воздух при той же температуре на плато Колорадо? (Допустим, что для доставки продуктов используются сморщенные мешочки, не ограничивающие расширение воздуха; недостающие данные следует взять из примера 3.)
Решение
Воспользуемся законом Бойля в форме уравнения (3-5), где индекс 1 будем относить к условиям на уровне моря, а индекс 2 — к условиям на высоте 2500 м над уровнем моря. Тогда Р1 = 1,000 атм, V1 = 100 см3, Р2 = 0,750 атм, а V2 следует вычислить. Итак,
- P1·V1 = Р2·V2
- 1,000 атм · 100 см3 = 0,750 атм · V2
откуда
- V2 = 133 см3
Надеюсь, что после изучения урока 25 «Закон Бойля-Мариотта» вы запомните зависимость объема и давления газа друг от друга.. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.