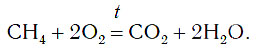Урок 18. Физические и химические свойства кислорода
В уроке 18 «Физические и химические свойства кислорода» из курса «Химия для чайников» выясним, какие физические и химические свойства имеет кислород и узнаем о реакциях горения.
Как у любого химического вещества, у кислорода есть свой набор физических и химических свойств, по которым его можно отличить от других веществ.
Содержание
Физические свойства
По своим физическим свойствам простое вещество кислород относится к неметаллам. При нормальных условиях он находится в газообразном агрегатном состоянии. Кислород не имеет цвета, запаха и вкуса. Масса кислорода объемом 1 дм3 при н. у. равна примерно 1,43 г.
При температуре ниже −183 °С кислород превращается в голубую жидкость, а при −219 °С эта жидкость переходит в твердое вещество. Это означает, что температура кипения кислорода равна: t кип.= −183 °С, а температура плавления составляет: t пл.= −219 °С. Кислород плохо растворяется в воде.
Химические свойства
Кислород является химически активным веществом. Он способен вступать в реакции с множеством других веществ, однако для протекания большинства этих реакций необходима более высокая, чем комнатная, температура. При нагревании кислород реагирует с неметаллами и металлами.
Если стеклянную колбу наполнить кислородом и внести в нее ложечку с горящей серой, то сера вспыхивает с образованием яркого пламени и быстро сгорает (рис. 80).
Химическую реакцию, протекающую в этом случае, можно описать следующим уравнением:
В результате реакции образуется вещество SO2, которое называется сернистым газом. Сернистый газ имеет резкий запах, который вы ощущаете при зажигании обычной спички. Это говорит о том, что в состав головки спички входит сера, при горении которой и образуется сернистый газ.
Подожженный красный фосфор в колбе с кислородом вспыхивает еще ярче и быстро сгорает, образуя густой белый дым (рис. 81).
При этом протекает химическая реакция:
Белый дым состоит из маленьких твердых частиц продукта реакции — P2O5.
Если в колбу с кислородом внести тлеющий уголек, состоящий в основном из углерода, то он также вспыхивает и сгорает ярким пламенем (рис. 82).
Протекающую химическую реакцию можно представить следующим уравнением:
Продуктом реакции является CO2, или углекислый газ, с которым вы уже знакомы. Доказать образование углекислого газа можно, добавив в колбу немного известковой воды. Помутнение свидетельствует о присутствии CO2 в колбе.
Возгорание уголька можно использовать для отличия кислорода от других газов. Если в сосуд (колбу, пробирку) с газом внести тлеющий уголек и он вспыхнет, то это указывает на наличие в сосуде кислорода.
Кроме неметаллов, с кислородом реагируют и многие металлы. Внесем в колбу с кислородом раскаленную стальную проволоку, состоящую в основном из железа. Проволока начинает ярко светиться и разбрасывать в разные стороны раскаленные искры, как при горении бенгальского огня (рис. 83).
При этом протекает следующая химическая реакция:
В результате реакции образуется вещество Fe3O4 (железная окалина). В состав формульной единицы этого вещества входят три атома железа, причем один из них имеет валентность II, а два других атома имеют валентность III. Поэтому формулу этого вещества можно представить в виде FeO * Fe2O3.
На заметку: Реакцию железа с кислородом используют для резки стальных изделий. Для этого определенный участок детали сначала нагревают с помощью кислородногазовой горелки. Затем направляют на нагретое место струю чистого кислорода, для чего перекрывают кран поступления горючего газа в горелку. Нагретое до высокой температуры железо вступает в химическую реакцию с кислородом и превращается в окалину. Так можно разрезать очень толстые железные детали.
Реакции горения
Общим для рассмотренных нами реакций является то, что при их протекании выделяется много света и теплоты. Очень многие вещества именно так взаимодействуют между собой.
Рассмотренные выше реакции простых веществ серы, фосфора, углерода и железа с кислородом являются реакциями горения.
Реакциями горения называются химические реакции, протекающие с выделением большого количества теплоты и света.
Кроме простых веществ, в кислороде горят и многие сложные вещества, например метан CH4. При горении метана образуются углекислый газ и вода:
В результате этой реакции выделяется очень много теплоты. Вот почему ко многим домам подведен природный газ, основным компонентом которого является метан. Теплота, выделяющаяся при горении метана, используется для приготовления пищи и других целей.
На заметку: Некоторые химические реакции протекают очень быстро. Такие реакции называют взрывными или просто взрывами. Например, взаимодействие кислорода с водородом может протекать в форме взрыва.
Горение может протекать не только в кислороде, но и в других газах. Об этих процессах вы узнаете при дальнейшем изучении химии.
Горение веществ на воздухе и в кислороде
Вы уже знаете, что в состав окружающего нас воздуха входит кислород. Поэтому многие вещества горят не только в чистом кислороде, но и на воздухе.
Горение на воздухе протекает чаще всего гораздо медленнее, чем в чистом кислороде. Происходит это потому, что в воздухе лишь одна пятая часть по объему приходится на кислород. Если уменьшить доступ воздуха к горящему предмету (а следовательно, уменьшить доступ кислорода), горение замедляется или прекращается. Отсюда понятно, почему для тушения загоревшегося предмета на него следует набросить, например, одеяло или плотную тряпку.
На заметку: При пожарах для тушения горящих предметов часто используют пену (рис. 84). Она обволакивает горящий предмет и прекращает доступ к нему кислорода. Горение сначала замедляется, а затем прекращается совсем.
Некоторые вещества, быстро сгорающие в кислороде, на воздухе не горят вообще. Так, если нагреть железную проволоку на воздухе даже до белого каления, она все равно не станет гореть, тогда как в чистом кислороде быстро сгорает с образованием раскаленных искр.
Краткие выводы урока:
- При обычных условиях кислород — газ, не имеющий цвета, запаха и вкуса, плохо растворимый в воде.
- Кислород обладает высокой химической активностью. Он вступает в химические реакции со многими простыми и сложными веществами.
- Химические реакции, протекающие с выделением большого количества теплоты и света, называют реакциями горения.
- В чистом кислороде вещества горят намного быстрее, чем на воздухе.
Надеюсь урок 18 «Физические и химические свойства кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.