Урок 16. Кислоты и основания
В уроке 16 «Кислоты и основания» из курса «Химия для чайников» дадим определение кислотам и основаниям, рассмотрим процесс их диссоциации в водном растворе и различия слабых кислот и оснований от сильных. Кроме того, вы узнаете самые распространенные кислоты и основания. Основы химии, которые вы должны знать перед прочтением данного урока, содержатся в уроке 9 «Ионы в водном растворе».
Что такое кислота и основание?
Для тех, кто только к нам присоединился напоминаю, что ионы — это все те же атомы веществ, просто с бОльшим или меньшим количеством электронов относительно числа протонов. Для кислот и оснований наиболее популярны следующие определения:
Кислота — это вещество, которое при добавлении к воде повышает концентрацию ионов водорода [H+].
Основание — это вещество, которое при добавлении к воде повышает концентрацию гидроксидных ионов [OH—]. Забегая вперед, скажу, что основанием также называют вещество, которое забирает ионы водорода [H+].
Если данные определения вам не понятны, то скорее всего вам нужно вспомнить, что такое простые и сложные ионы. Дальше все будет проще, ведь сложные лишь определения!
Диссоциация кислот
Диссоциация кислот, от HF до HNO3, в водном растворе сопровождается высвобождением одного протона, т.е иона водорода H+.
- HNO3 → H+(водн.) + NO3—(водн.)
В дальнейшем не будем указывать сокращение (водн.), означающее что ион гидратирован, поскольку в водном растворе любой ион гидратирован. Кислоты H2CO3, H2SO3 и H2SO4 диссоциируют в водном растворе с высвобождением двух протонов. Это происходит не в одну, а в две стадии:
- H2CO3 → H+ + HCO3— → 2H+ + CO—
- H2SO3 → H+ + HSO3— → 2H+ + SO—
- H2SO4 → H+ + HSO4— → 2H+ + SO42-
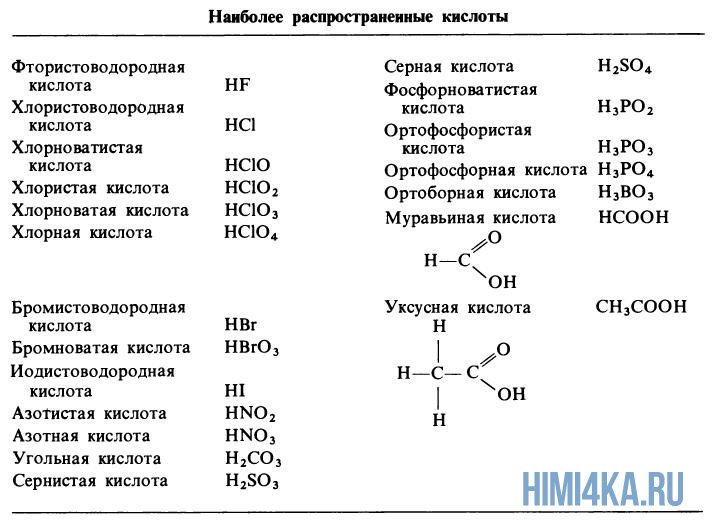
Угольная кислота дает протоны в раствор только частично, так помимо смеси HCO3— и CO— ионов в водном растворе присутствует немного недиссоциированной угольной к-ты. Зато серная кислота полностью высвобождает первый из двух ионов H+, поэтому она считается сильной кислотой. Самые распространенные сильные кислоты — это хлористоводородная и азотная, а распространенная слабая кислота — фосфорная кислота.
Каждая фосфорсодержащая кислота высвобождает в водном растворе три протона, и соответственно осуществляется это в 3 стадии:
- H3PO4 → H+ + H2PO4— → 2H+ + HPO42- → 3H+ + PO43-
Органические кислоты, такие как уксусная и муравьиная кислота, дают H+ из своих карбоксигрупп –COOH.
- CH3 –COOH → CH3 –COO— + H+
Диссоциация оснований
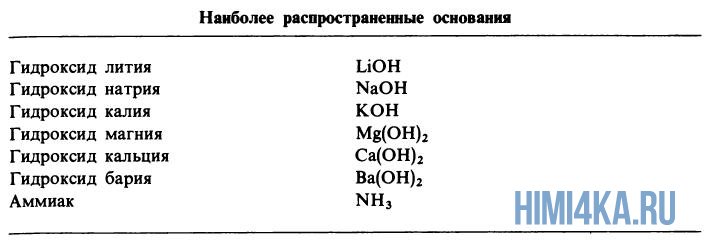
Диссоциация оснований, содержащие OH-группы (гидроксигруппы), например LiOH или Ca(OH)2, дает в водный раствор гидроксидные ионы OH—:
- LiOH → Li+ + OH—
- Ca(OH)2 → Ca2+ + 2OH—
Хотя у аммиака отсутствуют OH— ионы, тем не менее NH3 является основанием, поскольку он образует гидроксидные ионы при реакции с молекулами воды:
- NH3 + H2O → NH4+ + OH—
Надеюсь урок 16 «Кислоты и основания» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.