Урок 12. Элементный анализ
В уроке 12 «Элементный анализ» из курса «Химия для чайников» рассмотрим анализ химического состава вещества; научимся определять эмпирическую формулу соединения; кроме того разберем кучу примеров на нахождение весовых процентов и формулы вещества. Данный урок потребует от вас знания, что из себя представляет молекулярная формула соединения, а так же общих сведений, изложенных в первой главе «Атомы, молекулы и ионы». Обязательно прочитайте о законе сохранения массы и энергии, потому что все уроки из данного раздела посвящены именно ему.
Содержание
Анализ химического состава вещества
Анализ химического состава вещества или элементный анализ выполняют так: сначала разлагают исходное химическое соединение на отдельные элементы, а затем измеряют их относительные количества, выраженных в граммах на 100 грамм исходного вещества, либо в весовых (массовых) процентах. На практике это можно проделать, например, с углеводородом — соединением, содержащим лишь атомы углерода C и водорода H. Если известное количество углеводорода сжечь в кислороде, то образуется CO2 (диоксид углерода) и H2O, количество которых нужно затем измерить.
Пример 1: При сжигании неизвестного углеводорода массой 25 г образуется 68,58 г CO2 и 56,15 г H2O. Сколько граммов углерода и водорода содержится в исходном образце?
Решение:
Атомная масса C равна 12,011 г/моль, а молекулярная масса CO2 равна 12,011 + 2×15,999 = 44,010 г/моль. Сначала найдем относительное содержание C в CO2:
- (12,011/44,010)×100 = 27,29% углерода
Если 27,29% CO2 представляют собой углерод, то количество углерода, содержащееся в 68,58 г CO2, равно
- 27,29%×68,58 г = 18,72 г углерода
Аналогичный расчет содержания H в воде дает
- (2×1,008/18,015)×100 = 11,19% водорода
- 11,19%×56,15 г = 6,283 г водорода
Проверка: 18,72 г + 6,283 г = 25,00 г
Пример 2: Сколько граммов C содержится в 100 г образца углеводорода, рассмотренного в примере 1?
Решение:
- (100 г / 25,0 г)×18,72 г углерода = 74,88 г углерода на 100 г образца
Пример 3: Каков состав (в весовых процентах) углеводорода, рассматриваемого в примере 1?
Решение:
- (18,72 г углерода / 25,00 г образца)×100% = 74,88% углерода
- (6,28 г водорода / 25,00 г образца)×100% = 25,12% водорода
Если нам известен состав вещества в весовых процентах, можно воспользоваться атомными массами входящих в него элементов и вычислить относительное число атомов каждого элемента в соединении.
Пример 4: Вычислите относительное число атомов C и H в соединении, рассматриваемом в примере 3.
Решение:
Такие вычисления легче проводить, исходя из 100,0 г вещества: тогда весовые проценты, в которых выражен элементный состав соединения, можно просто заменить на такое же число граммов соответствующих элементов (ср. примеры 3 и 2). Теперь разделим массу C и массу H на их атомные массы:
- 74,88 г углерода / 12,011 г/моль = 6,234 моля углерода
- 25,12 г водорода / 1,008 г/моль = 24,92 моля водорода
Таковы относительные количества молей C и H в неизвестном углеводороде, и вот тут-то мы убедимся, насколько удобно пользоваться представлением о моле. Полученные выше численные значения должны также выражать относительные количества атомов углерода и водорода в соединении, то есть на каждые 6,234 атома углерода в неизвестном углеводороде приходится 24,92 атома водорода. Если мы попытаемся найти общее кратное этих двух чисел, то окажется, что они находятся в соотношении 1:4. Разделив оба числа на меньшее из них (16,234), мы найдем, на каждый атом углерода приходится 24,92/6,234=3,997, т.е 4 атома водорода.
Пример 5: Жидкость содержит 11,19 вес.% водорода и 88,81 вес.% кислорода. Каковы относительные количества атомов водорода и кислорода в этой жидкости?
Решение:
Рассмотрим снова 100 г вещества и вычислим количество молей каждого элемента, входящего в его состав:
- 11,19 г водорода / 1,008 г/моль = 11,10 моля водорода
- 88,81 г кислорода / 15,999 г/моля = 5,551 моля кислорода
Разделим оба числа на меньшее из них, чтобы найти общее кратное и тогда мы получим, что на каждый атом кислорода приходится по два атома водорода.
Пример 6 решаем самостоятельно: Обычный лабораторный растворитель, углеводород, содержит 92,26 вес.% углерода и 7,74 вес.% водорода. Каковы относительные количества атомов углерода и водорода в этом соединении?
Ответ: на 1 атом углерода приходится по 1 атому водорода
Эмпирическая формула вещества
Одним лишь элементным анализом невозможно определить правильную молекулярную формулу соединения. Например, с результатами вычислений в примере 4 согласуется формула метана -CH4, но те же аналитические результаты могли бы согласоваться с молекулярными формулами C2H8, C3H12 или C4H16, если бы подобные молекулы существовали. Вещество в примере 5 может быть водой H2O, но могло бы иметь формулу H4O2 или еще более сложную, но кратную H2O.
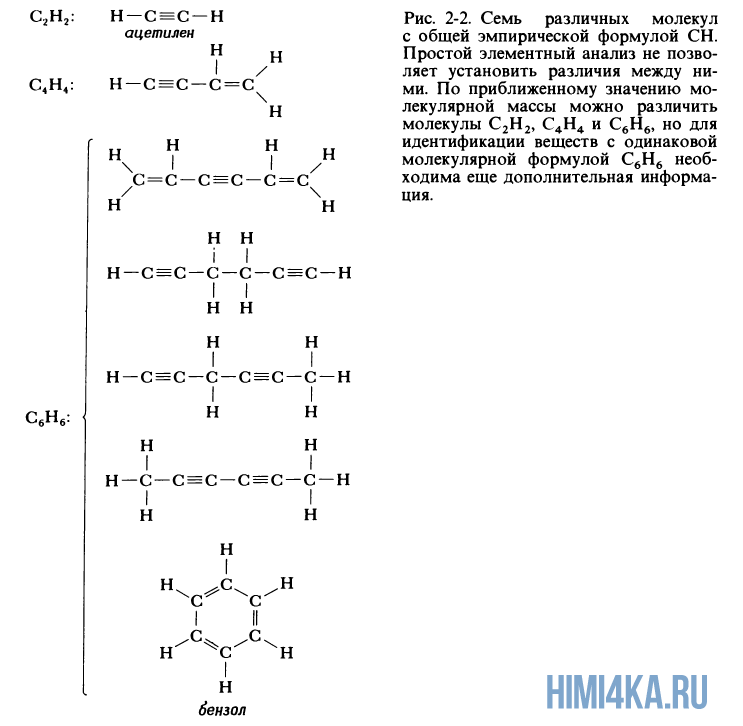
Химическая формула, указывающая относительные количества атомов каждого из элементов в соединении при помощи целых чисел, не имеющих общего кратного, называется эмпирической формулой соединения. Элементный анализ вещества приводит именно к эмпирической формуле соединения, а не к молекулярной формуле, которая может совпадать с эмпирической формулой, но может представлять собой ее целое кратное. Для метана и воды эмпирические формулы совпадают с молекулярными формулами CH4 и H2O. Например вещество из примера 6 имеет эмпирическую формулу CH, но молекулярная формула может представлять собой бензол С6H6, ацетилен C2H2 или любой из пяти других, менее распространенных углеводородов, молекулы которых изображены на рисунке 2-2.
Определение формулы вещества
Закрепим полученные знания заключительным примером:
Глюкоза содержит 40,00 вес.% углерода, 6,71 вес.% водорода и 53,29 вес.% кислорода. Каковы ее эмпирическая и молекулярная формулы, если из других экспериментов известно, что глюкоза имеет молекулярную массу, приблизительно равную 175 г/моль?
Решение:
Найдем сначала число молей каждого элемента, приходящихся на 100 г глюкозы:
- 40,00 г углерода / 12,011 г/моль = 3,330 моля углерода
- 6,71 г водорода / 1,008 г/моль = 6,66 моля водорода
- 53,29 г кислорода / 15,999 г/моль = 3,331 моля кислорода
Очевидно, что эмпирическая формула вещества должна иметь вид CH2O. Найденной эмпирической формуле глюкозы соответствует молекулярная масса
- 12,011 + (2×1,008) + 15,999 = 30,026 г/моль
Приближенная молекулярная масса из экспериментов почти в 6 раз превышает это значение, поэтому можно сделать вывод, что молекулярная формула глюкозы имеет вид C6H12O6.
Урока 12 «Элементный анализ» очень важный, поэтому если у вас возникли вопросы, пишите их в комментарии.