Урок 10. Ионы в газе
В уроке 10 «Ионы в газе» из курса «Химия для чайников» выясним какие газы называются инертными или благородными; рассмотрим эксперимент с катодными а каналовыми лучами в круксовой трубке и узнаем как открыли электрон. Будет неплохо, если перед изучением данного урока вы вспомните, что такое ионы.
Инертные или благородные газы
В середине XIX веке ученые полагали, что взаимодействие между молекула-молекула или атом-атом имеет исключительно электрическую природу. «Ведь одноименные заряды отталкиваются, — рассуждали они, — а значит молекула не может быть образована двумя одинаковыми атомами, так как между ними не может возникать связи». Поэтому абсолютно все газы ученые того времени считали одноатомными газами. Например молекулярная формула кислорода в их представлении была просто O, вместо двухатомной молекулы O2. Даже молекула воды у них считалась не H2O, а HO, так как два атома водорода улетели бы друг от друга прочь. Разумеется, ученые того времени заблуждались.
Но это не означает, что в природе не существует одноатомных газов, напротив, существует целых 6 одноатомных газов: гелий, неон, аргон, криптон, ксенон и радон. Они еще называются инертные или благородные газы. Благородный газ — это такой газ, атомы которого при нормальных условиях являются инертными, т.е не взаимодействуют друг с другом, а значит не образуют химических связей.
Катодные лучи
Путаница, что все газы в природе исключительно одноатомные, поставила паузу в изучении химии на полвека. Позже Льюис высказал предположение о том, что общая электронная пара является чем-то вроде клея, который сцепляет между собой атомы с образованием ковалентной связи. Лишь спустя 20 лет его гипотеза обрела теоретическое объяснение. Фарадей показал через опыт электролиза, что заряды на ионах всегда кратны некоторым элементарным единицам заряда, причем моль этих зарядов составляет 1F, а физик Джордж Стоуни назвал эту элементарную единицу заряда — электрон. Однако «электрон» Стонея еще так и оставался гипотезой.
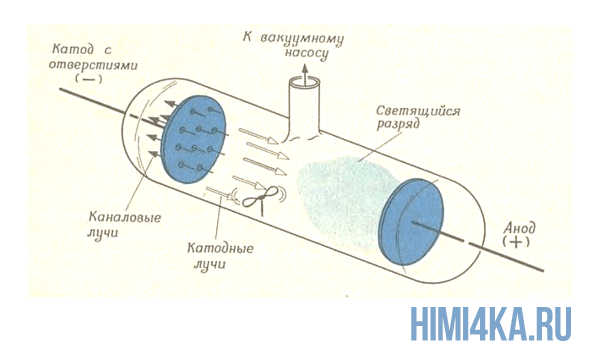
То, что электроны являются реальными частицами, которые могут быть присоединены к атомам или удалены от них, было установлено физиками, изучающими влияние электричества на свойства газов. И вот одним прекрасным вечером они обнаружили, что если к двум электродам, впаянным в стеклянную трубку (круксова трубка) с разреженным газом (газ по очень низким давлением), приложено напряжение около 10000 В, оно вырывает у молекул разряженного газа их электроны. Тем самым образуются катодные и каналовые лучи. Катодные лучи представляют собой поток электронов летящих по направлению к аноду, а каналовые лучи — это поток положительных ионов устремленных к катоду. Если на пути катодных лучей в стеклянной трубке расположить легчайшую вертушку, то можно доказать существование электрона: поток электронов, образующий катодные лучи, заставит вертушку вращаться. Еще столкновение электронов с молекулами газа способно привести к возникновению светящегося заряда, знакомого всем нам по газоразрядным лампам. Цвет разряда может быть разным в зависимости от того, какой газ находится внутри трубки.
Открытие электрона
Если перед катодом в круксовой трубке установить металлическую пластинку со щелью, то можно получить тонкий пучок катодных лучей, т.е электронов. Этот пучок отклоняется электрическим и магнитным полями, и хракактер отклонения позволяет заключиь, что частицы пучка несут в себе отрицательные заряды. Относительная величина отклонения каналовых лучей (положительных ионов) и катодных лучей (отрицательных ионов) показывает, что частицы, образующие катодные лучи, очень легкие, а положительные ионы почти настолько же тяжелые, как и исходные атомы, из которых они получены. Конкретный состав каналовых лучей зависит от того, какой газ содержится в трубке, а катодные лучи одинаковы для всех газов. Дж. Томсон предположил, что частицы, образующие катодные лучи, представляют собой не что иное, как гипотетические «электроны» Стонея, а в 1897 году он нашел способ, измерив отклонения пучка катодных лучей в электрическом и магнитном полях, вычислить отношение заряда этих частиц к их массе (e/m). Томсон установил, что
- e / m = 1,76·108 Кл/г
Предположим, что частицы, которые согласно Томсону, образуют катодные лучи, представляют собой электроны Стонея и Фарадея и что 1 F — это заряд 1 моля электронов. Вычислим массу 1 электрона:
Заряд 1 электрона равен
- e = 1F / N = 96485 Кл/моль / 6,022·1023 электрон/моль = 1,602·10-19 Кл
Отсюда
- m = 1,602·10-19 Кл / 1,76·108 Кл/г = 0,910·10-27 г
Урок 10 «Ионы в газе» был последним в разделе «Атомы, молекулы и ионы». Чтобы все основы химии, полученные при изучении уроков данной главы, глубоко осели в вашей памяти, настоятельно рекомендую внимательно прочитать заключение от корки до корки.