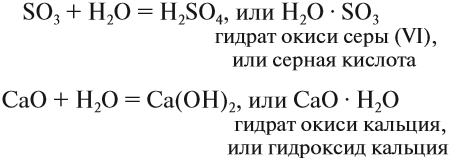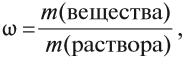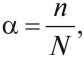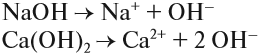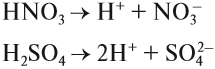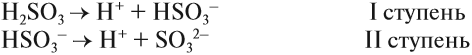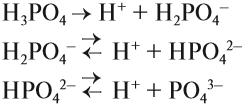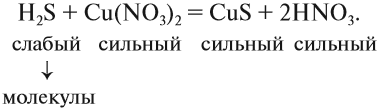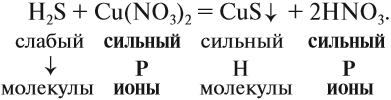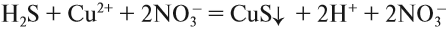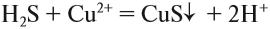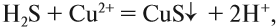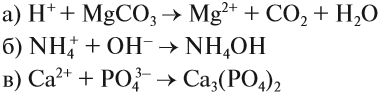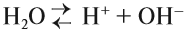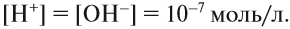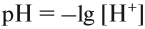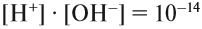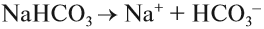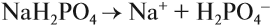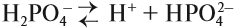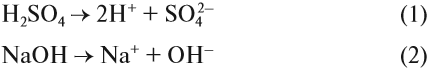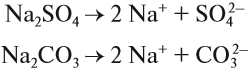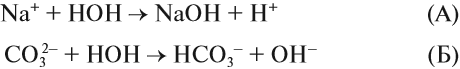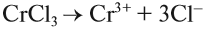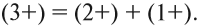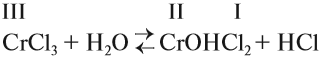Урок 6. Растворы

Содержание
Понятие о растворах
Нет на Земле человека, который никогда не видел бы растворов. А что это такое?
Раствор — это однородная (гомогенная) смесь двух или более компонентов (составных частей, или веществ).
Что такое однородная смесь? Однородность смеси предполагает, что между составляющими её веществами отсутствует поверхность раздела. В этом случае невозможно, по крайней мере, визуально, определить, сколько веществ образовало данную смесь. Например, глядя на стакан водопроводной воды, трудно предположить, что в ней, кроме молекул воды, содержится еще добрый десяток ионов и молекул (О2, СО2, Са2+ и другие). И никакой микроскоп не поможет увидеть эти частицы.
Но отсутствие поверхности раздела — не единственный признак однородности. В однородной смеси состав смеси в любой точке одинаков. Поэтому для получения раствора нужно тщательно перемешать образующие его компоненты (вещества).
Растворы могут иметь разное агрегатное состояние:
- газообразное (например, смесь газов: О2, N2, СО2, Аr образуют воздух);
- жидкое (например, одеколон, сироп, рассол);
- твёрдое (например, сплавы).
Одно из веществ, которые образуют раствор, называется растворителем. Растворитель имеет то же агрегатное состояние, что и раствор. Так, для жидких растворов — это жидкость: вода, масло, бензин и т. д. Чаще всего на практике применяются водные растворы. О них и пойдет далее речь (если не будет сделана соответствующая оговорка).
Что происходит при растворении различных веществ в воде? Почему одни вещества хорошо растворяются в воде, а другие — плохо? От чего зависит растворимость — способность вещества растворяться в воде?
Представим себе, что в стакан тёплой водой положили кусочек сахара. Полежал он, уменьшился в размерах и… исчез. Куда? Неужели нарушается Закон сохранения вещества (его массы, энергии)? Нет. Сделайте глоток полученного раствора, и вы убедитесь, что вода сладкая, сахар не исчез. Но почему его не видно?
Дело в том, что в ходе растворения происходит дробление (измельчение) вещества. В данном случае кусочек сахара распался на молекулы, а их мы видеть не можем. Да, но почему сахар, лежащий на столе, не распадается на молекулы? Почему кусочек маргарина, опущенный в воду, тоже никуда не исчезает? Дело в том, что дробление растворяемого вещества происходит под действием растворителя, например воды. Но растворитель сможет «растащить» кристалл, твёрдое вещество на молекулы, если сумеет «уцепиться» за эти частицы. Другими словами, при растворении вещества должно быть взаимодействие между веществом и растворителем. Такое взаимодействие между веществом и растворителем называется сольватацией, а в случае воды — гидратацией.
Когда возможно такое взаимодействие? Только в том случае, когда строение веществ (и растворяемого, и растворителя) похоже, подобно. Издавна известно правило алхимиков: «подобное растворяется в подобном». В наших примерах молекулы сахара полярны, и между ними и полярными молекулами воды существуют определённые силы взаимодействия. Такие силы отсутствуют между неполярными молекулами жира и полярными молекулами воды. Поэтому жиры в воде не растворяются. Таким образом, растворимость зависит от природы растворяемого вещества и растворителя.
В результате взаимодействия между растворяемым веществом и водой образуются соединения — гидраты. Это могут быть очень прочные соединения:
Такие соединения существуют как индивидуальные вещества: основания, кислородсодержащие кислоты*.
Их общее название — гидроксиды.
Естественно, при образовании таких прочных соединений возникают прочные химические связи, выделяется теплота. Так, при растворении СаО (негашёная известь) в воде выделяется так много теплоты, что смесь закипает.
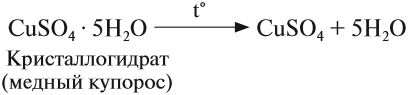
Но почему при растворении сахара или соли в воде полученный раствор не нагревается? Во-первых, далеко не все гидраты так прочны, как серная кислота или гидроксид кальция. Существуют гидраты солей (кристаллогидраты), которые легко разлагаются при нагревании:
Многие гидраты не выделены в свободном виде, а это означает, что при их образовании выделяется сравнительно мало теплоты.
Во-вторых, всегда при растворении, как уже упоминалось, идёт процесс дробления. А на это, естественно, затрачивается энергия, поглощается теплота.
Поскольку оба процесса происходят одновременно, раствор может нагреваться или охлаждаться в зависимости от того, какой процесс преобладает.
Вопрос. Какой процесс: дробление или гидратация преобладает в каждом случае:
- при растворении серной кислоты в воде, если раствор нагрелся;
- при растворении нитрата аммония в воде, если раствор охладился;
- при растворении поваренной соли в воде, если температура раствора практически не изменилась в ходе растворения.
Поскольку при растворении изменяется температура раствора, естественно предположить, что растворимость зависит от температуры. Действительно, растворимость большинства твёрдых веществ увеличивается при нагревании. Растворимость газов при нагревании уменьшается. Поэтому твёрдые вещества обычно растворяют в тёплой или горячей воде, а газированные напитки хранят на холоде.
Растворимость (способность растворяться) веществ не зависит от измельчения вещества или интенсивности перемешивания. Но, измельчая вещество, перемешивая готовый раствор, можно ускорить процесс растворения. Таким образом, изменяя условия получения раствора, можно получать растворы разных составов. Естественно, существует предел, достигнув которого легко обнаружить, что вещество больше не растворяется в воде. Такой раствор называется насыщенным. Для хорошо растворимых веществ насыщенный раствор будет содержать много растворённого вещества. Так, насыщенный раствор KNO3 при 100 °C содержит 245 граммов соли на 100 граммов воды (в 345 граммах раствора), это концентрированный раствор. Насыщенные растворы плохо растворимых веществ содержат ничтожные массы растворённых соединений. Так, насыщенный раствор хлорида серебра содержит 0,15 мг AgCl в 100 г воды. Это очень разбавленный раствор.
Таким образом, если раствор содержит много растворённого вещества по отношению к растворителю, то он называется концентрированным, если вещества мало — то разбавленным. Очень часто от состава раствора зависят его свойства, а значит, и применение.
Так, разбавленный раствор уксусной кислоты (столовый уксус) используют как вкусовую приправу, а концентрированный раствор этой кислоты (уксусная эссенция) может вызвать смертельный ожог при неосторожном применении (приёме внутрь).
Для того чтобы точно отразить состав растворов, используют величину, равную массовой доле растворенного вещества ω:
где m(вещества) — масса растворённого вещества в растворе; m(раствора) — общая масса раствора, содержащая растворённое вещество и растворитель.
Так, если 100 граммов уксуса содержат 6 граммов уксусной кислоты, то речь идёт о 6 %-ном растворе уксусной кислоты (это — столовый уксус). Способы решения задач с использованием понятия массовой доли растворённого вещества рассмотрены в уроке 30.2.

Электролитическая диссоциация
Всем известно, что металлы проводят электрическим ток. А проводят ли электрический ток растворы? Если бы мы попытались ответить на этот вопрос при помощи опыта, то убедились бы, что раствор сахара не проводит электрический ток, а раствор поваренной соли проводит. Почему? Может быть, исходные вещества — вода или сухой хлорид натрия — электропроводны? Но аналогичный опыт показывает — эти вещества, каждое само по себе, электрический ток проводить не могут.
Для того чтобы объяснить результаты этих опытов и понять смысл явления, необходимо ответить на вопрос: почему вообще некоторые вещества, например металлы, проводят электрический ток? Это происходит потому, что в металлах имеются «свободные» заряженные частицы — электроны. С направленным движением этих заряженных частиц связана электропроводность металлов. Таким образом, если раствор NаСl проводит электрический ток, то, значит, в этом растворе тоже образуются какие-то заряженные частицы. Если раствор сахара не проводит электрический ток, значит, в растворе сахара заряженных частиц не образуется. Исходя из этого, такие вещества называют:
- NаСl — электролит;
- Сахар — неэлектролит.
Итак: ЭЛЕКТРОЛИТЫ — это вещества, растворы (и расплавы) которых проводят электрический ток. А ПОЧЕМУ?
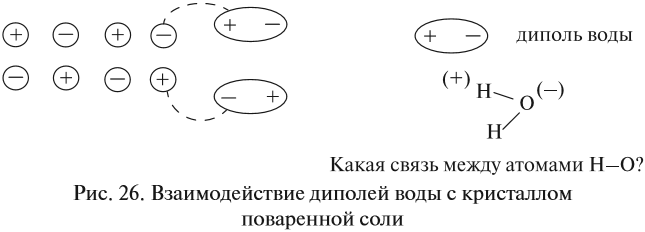
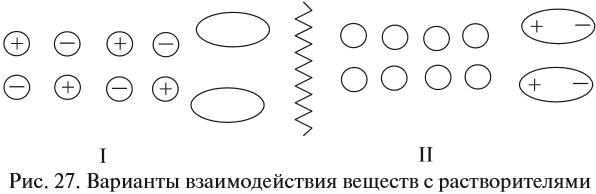
Теперь нам осталось выяснить: откуда в растворе NаСl появились заряженные частицы? Вспомните, какой тип химической связи имеется в кристалле поваренной соли? Ионная связь! То есть связь между заряженными частицами — ионами. Значит, хлорид натрия состоит из разноимённо заряженных частиц! Но почему тогда сухой хлорид натрия не проводит электрический ток? Потому что между ионами в кристалле существуют достаточно сильные электростатические взаимодействия. А в воде? Посмотрите на рис. 26.
Между ионами соли и молекулами воды возникают довольно значительные силы электростатического взаимодействия. В результате молекулы воды «растаскивают» кристалл на «кусочки» (ионы). Будут ли возникать такие взаимодействия в следующих случаях (рис. 27)?
Очевидно, нет! В обоих случаях или растворитель (случай I), или вещество (случай II) неполярны, и взаимодействия, притяжение частиц друг к другу, ничтожны.
Вывод. Взаимодействие между веществом и растворителем возможно, если и вещество, и растворитель имеют достаточно полярные связи.
Следствием такого взаимодействия является диссоциация — распад вещества на ионы. При этом образуются положительно заряженные ионы — катионы и отрицательно заряженные ионы — анионы.
Электролитическая диссоциация — процесс распада электролитов на ионы под действием полярных молекул растворителя (чаще всего — воды).
Задание 6.1. Будут ли проводить электрический ток:
- раствор НСl в воде;
- раствор NаСl в бензине;
- раствор азота в воде;
- 100 %-ная серная кислота?
Дайте пояснения.
Если вы всё правильно поняли и правильно ответили, то электропроводность возникнет только в первом случае, а в остальных случаях отсутствуют необходимые для этого условия. Попробуйте сформулировать, какие это условия? Итак.
Итак.
Вещества, способные в растворах или расплавах распадаться на ионы и, как следствие, проводить в этом состоянии электрический ток, называются электролитами.
К электролитам относят:
- основания;
- кислоты;
- соли.
Это могут быть как неорганические, так и органические вещества. Правда, большинство органических веществ являются неэлектролитами. Это углеводороды (бензин), углеводы (сахар), спирты (глицерин) и другие (см. уроки 17–28 данного самоучителя).
Задание ЕГЭ. Электролитом является каждое из двух веществ:
- глюкоза и этиловый спирт;
- ацетат натрия и гидроксид калия;
- уксусная кислота и бензол;
- сахар и повареная соль.
Задание ЕГЭ. Электрический ток проводят:
- спиртовой раствор йода,
- расплав парафина,
- расплав ацетата калия,
- водный раствор глюкозы.
Если проверить электропроводность растворов электролитов одного класса, например кислот, то окажется, что в одном случае лампочка вспыхивает ярко, в другом — еле светится. Если принять во внимание, что концентрация веществ в обоих растворах одинакова, — как можно объяснить наблюдения?
Объяснение одно — в первом случае образуется большее число ионов (заряженных частиц), во втором — меньшее. То есть в первом случае электролитическая диссоциация идёт в значительней степени. Такие электролиты называются сильными, и в их растворах много ионов или почти нет (а иногда и совсем нет) молекул. Эти вещества построены по ионному типу или содержат сильнополярные ковалентные связи.
К СИЛЬНЫМ электролитам относятся:
- почти все соли;
- кислоты: НСl, НВr, НI, НNО3, Н2SО4, HClO4 и др.;
- щёлочи (кроме NН4ОН).
Вопрос. Что такое «щёлочь»? (В случае затруднений — см. урок 2.3.)
В растворах слабых электролитов много молекул вещества и мало ионов; электролитическая диссоциация идёт не полностью.
К слабым электролитам относятся:
- вода;
- кислоты: Н2СО3, Н2S, Н2SiО3, НNО2 и др.;
- NН4ОН и нерастворимые основания.
Фосфорная и сернистая кислоты — электролиты средней силы.
Задание 6.2. Выучите наизусть формулы сильных и слабых электролитов. Вспомните их названия.
Силу электролита можно оценить при помощи степени диссоциации α, которая показывает, какая часть растворённых молекул распалась на ионы:
где n — число молекул, распавшихся на ионы; N — общее число молекул электролита в растворе.
В разбавленных растворов сильных электролитов степень диссоциации α = 1 (или близка к этой величине), т. е. молекул практически нет. Для слабых электролитов α < 0,05, то есть в разбавленных растворах слабых электролитов число распавшихся молекул не превышает 5 %. В растворах таких веществ очень мало ионов по сравнению с общим числом растворённых молекул электролита.
Обратите внимание, что в обоих случаях речь идёт о разбавленных растворах, поскольку α зависит от разбавления: в концентрированном растворе даже очень сильного электролита очень мало молекул растворителя. А именно молекулы растворителя являются причиной диссоциации.
Как же происходит электролитическая диссоциация?
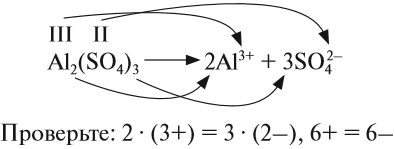
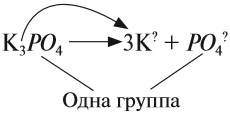
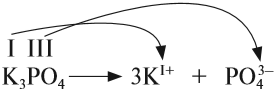
СОЛИ диссоциируют на катион металла (или аммония) и анион кислотного остатка. При составлении таких уравнений следует учитывать правила, которые необходимо запомнить:
- Заряд иона совпадает по величине с валентностью данного атома (группы атомов);
- Число катионов и анионов может быть различным, но суммарный положительный заряд катионов равен суммарному отрицательному заряду анионов. Раствор остается электронейтральным!
Вывод. Для составления уравнения электролитической диссоциации:
- составьте химическую формулу соединения, укажите валентность составных частей;
- по индексам укажите число образовавшихся ионов:
- по валентности укажите заряды ионов:
Задание 6.3. Составьте уравнения электролитической диссоциации нитрата хрома (III), карбоната натрия, сульфида калия, сульфата железа (III), сульфата железа (II).
ОСНОВАНИЯ диссоциируют на катион металла (или аммония NH4+) и анион ОН–:
Задание 6.4. Составьте уравнения диссоциации гидроксида калия; гидроксида аммония, гидроксида бария.
КИСЛОТЫ диссоциируют на катион водорода и анион кислотного остатка:
Задание 6.5. Составьте уравнения диссоциации соляной кислоты, серной кислоты, фосфорной кислоты.
Для многоосновных кислот диссоциация может происходить ступенчато. Это означает, что на каждой стадии отщепляется только один ион водорода. Например:
Задание 6.6. Составьте уравнения ступенчатой (постадийной) диссоциации фосфорной кислоты.
Проверьте себя:
Вопрос. Какой из этих процессов идёт в большей степени, то есть какие ионы образуются в большей степени: Н2РО4–, НРО42– или РО43–?
Поскольку отрыв катиона от двухзарядного аниона в высшей степени затруднён (более реальным кажется обратный процесс), то последний процесс практически не происходит. Поэтому по первой стадии Н3РО4 диссоциирует как сильная кислота, а по последней — как очень слабая, причём в растворе фосфорной кислоты фосфат-ионов РО43– практически нет.
В целом, сила кислоты определяется:
- её составом;
- степенью окисления центрального атома (чем она больше, тем сильнее кислота);
- стадией диссоциации её.
Вопрос. Предположите, какая кислота более сильная:
- азотная или азотистая;
- серная или сернистая?
Задание ЕГЭ. Какие суждения о диссоциации кислот в водных растворах верны?
- Кислоты в воде диссоциируют с образованием в качестве катиона только иона Н+.
- Среди анионов, образующихся при диссоциации кислот, могут присутствовать разные кислотные остатки.
Разумеется, верны оба суждения.
Задание ЕГЭ. В каком из растворов с одинаковой молярной концентрацией содержание фосфат-ионов наибольшее:
- NaH2PO4;
- Na2HPO4;
- H3PO4;
- Na3PO4.
Сила оснований также зависит от заряда иона (валентности) металла: чем он больше, тем слабее электролит (при прочих равных условиях). Так, гидроксид кальция слабее гидроксида натрия, а гидроксид железа (III) слабее гидроксида железа (II).

Ионно-молекулярные уравнения реакций
Из вышеизложенного следует, что в растворах большинства неорганических веществ, наряду с молекулами, находится значительное число ионов. В таком случае уравнения реакций, которые показывают состав молекул реагирующих веществ, весьма условны. Более точно отражают состав реагирующих частиц ионно-молекулярные уравнения.
Для того чтобы составить ионно-молекулярное уравнение реакции, нужно записать в виде ИОНОВ химические формулы:
- сильных и одновременно
- растворимых электролитов.
Состав всех остальных веществ изображается в виде молекул.
На практике, при составлении таких уравнений рекомендуется следовать следующему алгоритму:
1. Определить силу реагирующих электролитов:
2. Для сильных электролитов определить растворимость (по таблице растворимости):
3. Формулы сильных и одновременно растворимых электролитов записать в виде ионов, остальные формулы НЕ ИЗМЕНЯТЬ!
4. Одинаковые ионы «вычеркиваем», так как они не участвуют в реакции (не изменили ни состава, ни заряда), получаем краткое ионно-молекулярное уравнение:
Краткое ионно-молекулярное уравнение показывает:
- что реакция возможна;
- что в результате реакции образуется осадок (СuS);
- какие ионы или молекулы должны участвовать в аналогичном процессе.
Для того, чтобы переписать краткое ионно-молекулярное уравнение в молекулярном виде, необходимо вместо:
- ионов H+ написать формулу сильной кислоты;
- ионов ОH— написать формулу щёлочи;
- остальных ионов написать формулу растворимой соли.
Например, для того чтобы осуществить процесс:
вместо нитрата меди можно взять любую растворимую соль меди (II), так как она при электролитической диссоциации посылает в раствор ион меди, а анион соли в реакции не участвует:
Задание 6.7. Составьте молекулярные и ионно-молекулярные уравнения реакции для этих процессов и убедитесь, что краткие ионно-молекулярные уравнения реакций у них одинаковые.
Задание 6.8. Записать в молекулярном и молекулярно-ионном виде уравнения, соответствующие предложенным кратким молекулярно-ионным уравнениям:
При составлении ионно-молекулярных уравнений может получиться так, что все частицы будут вычеркнуты, так как не изменят ни состава, ни заряда. В этом случае говорят, что реакция в растворе не идёт. В принципе, можно заранее предсказать возможность такого процесса: реакция ионного обмена в растворе возможна, если происходит связывание ионов, т. е. образуется осадок, газ, слабый электролит или ион нового состава.
Задание 6.9. Составьте ионно-молекулярные уравнения реакций:
- фосфат натрия + хлорид кальция →
- карбонат бария + азотная кислота →
- гидроксид железа III + серная кислота →
- сульфат аммония + гидроксид калия →
- нитрат алюминия + хлорид натрия →
Сделайте заключение: возможны ли эти процессы. Укажите признаки возможных процессов (осадок, газ, слабый электролит).
Вывод: любая реакция ионного обмена протекает в сторону связывания ионов, поэтому в результате такой реакции образуется слабый электролит или осадок, или газ.

Понятие о рН (водородном показателе)
Вода — очень слабый электролит: при обычных условиях лишь одна молекула воды из 10 000 000 распадается на ионы:
Это уравнение показывает, что при диссоциации 1 моль молекул воды образуется 1 моль ионов водорода Н+ и 1 моль гидроксид-анионов ОН–. Другими словами: в чистой воде концентрация ионов водорода равна концентрации гидроксид-анионов:
Здесь: [Н+] — равновесная концентрация ионов водорода, моль/л; [OH–] — равновесная концентрация гидроксид-анионов, моль/л.
Такой раствор (среда) называется «нейтральный».
Характер среды — кислый, нейтральный — можно оценить количественно при помощи рН («пэ-аш»). Водородный показатель рН равен логарифму концентрации ионов водорода, взятому с обратным знаком*:
* Логарифм (lg) — это величина, равная показателю степени при основании 10. Например: lg 100 = lg 102 = 2.
Поэтому в случае чистой воды рН = 7.
Раствор, у которого рН = 7, называется нейтральным.
Если к чистой воде добавили кислоту, то увеличили концентрацию ионов водорода. Теперь эта концентрация составит, например 10–6 моль/л или 10–2 моль/л.
Такая среда (раствор) называется «кислая», или «кислотная». Причём в первом случае (рН = 6) среда считается слабокислой, а во втором (рН = 2) — сильнокислой, т. е. в любом случае рН < 7. Значение рН можно измерять и с большей точностью (например, рН = 5,36).
pН < 7, среда кислая.
При добавлении щёлочи увеличивается концентрация ионов ОН–, и одновременно уменьшается концентрация ионов Н+. Дело в том, что для любого водного раствора
Поэтому, если концентрация ионов ОН– составит 10–3, то [H+] = 10–11, т. е.
рН > 7, среда щелочная.
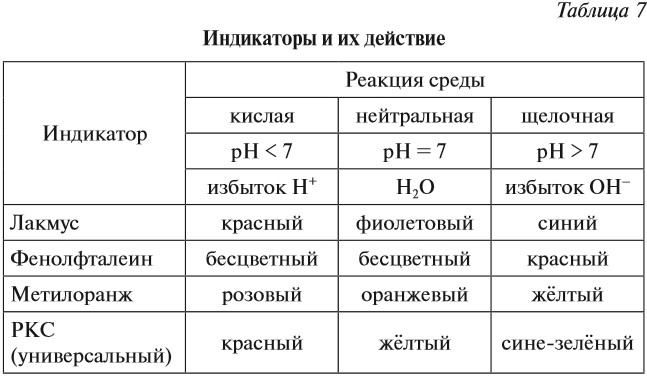
Определить реакцию среды конкретного раствора можно при помощи индикаторов.
Индикаторы — это вещества, которые изменяют свой цвет в присутствии избытка ионов Н+ или ОН–.
Ионы Н+ или ОН– действуют на молекулу индикатора, и индикатор меняет цвет по-разному в зависимости от реакции среды и вида самого индикатора (табл. 7).
Задание 6.10. Какую окраску будет иметь индикатор лакмус, если:
- рН < 7;
- [Н+] = 10–4 моль/л;
- в растворе есть избыток ОН–;
- рН = 7;
- [ОН–] = 10–8 моль/л;
- в растворе есть НNО3;
- [ОН–] = 0,1 моль/л.
Окраска индикаторов изменяется в растворах, которые содержат избыток одного из этих ионов. Ионы Н+ или ОН– могут образовываться в ходе диссоциации некоторых соединений.
Вопрос. Какие вещества при диссоциации образуют ионы Н+ или ОН–?
Эти ионы могут образовываться при диссоциации растворимых кислот, оснований, некоторых кислых и основных солей. Например, дигидрофосфат натрия образует при диссоциации ионы водорода, а гидрофосфат натрия — нет. Дело в том, что кислые соли могут диссоциировать ступенчато, если полученный на первой стадии анион соответствует сильному электролиту:
остаток слабого электролита → диссоциация не идёт;
остаток сильного электролита → диссоциация идёт:
Образуются ионы Н+, возникает кислая среда.
Кроме того, ионы Н+ или ОН– могут образовываться в ходе взаимодействия некоторых веществ с водой. Например, с водой могут взаимодействовать активные металлы, кислотные и основные оксиды.
Задание 6.11. Какую окраску будет иметь индикатор лакмус, если в воде растворить: кальций, оксид лития, оксид серы (IV)?

Гидролиз солей
Попробуйте ответить на вопрос: изменится ли окраска лакмуса в растворе серной кислоты? гидроксида натрия? сульфата натрия? карбоната натрия? В первых двух случаях можно уверенно сказать «да», так как при диссоциации образуются:
ионы водорода (уравнение 1) или гидроксид-анионы (уравнение 2), а индикаторы реагируют именно на избыток ионов Н+ или ОН–. Но при диссоциации упомянутых солей:
ионы Н+ и ОН– не образуются! Тем не менее раствор карбоната натрия изменяет окраску индикатора, а сульфата натрия — нет! Почему? Видимо, причина в том, что ионы карбоната натрия вступают в какую-то реакцию с молекулами воды, ведь только из молекулы воды может образоваться избыток Н+ или ОН–.
Гидролиз солей — это процесс взаимодействия ионов соли с молекулами воды, в результате чего изменяется рН раствора.
Какой ион карбоната натрия реагирует с водой? Предположим, что оба. Тогда в растворе происходят процессы:
Вспомните, что такое «сильный электролит», «слабый электролит», и ответьте на вопрос: какой из этих процессов (А или Б) НЕВОЗМОЖЕН в растворе?
Очевидно, невозможен процесс (А), так как молекул сильного электролита NаОН в растворе НЕТ, есть только ионы Na+ и ОН–, другими словами, связывания ионов не происходит.
Следовательно, происходит процесс (Б), и краткое ионномолекулярное уравнение гидролиза карбоната натрия выглядит так:
pH > 7, среда щелочная, лакмус синий.
И действительно, в растворе карбоната натрия лакмус становится синим. Почему именно карбонат-анион вступает в реакцию гидролиза? Потому что это ион, соответствующий СЛАБОМУ электролиту и в результате его взаимодействия с водой образуется СЛАБЫЙ электролит (вспомните условия протекания ионных процессов).
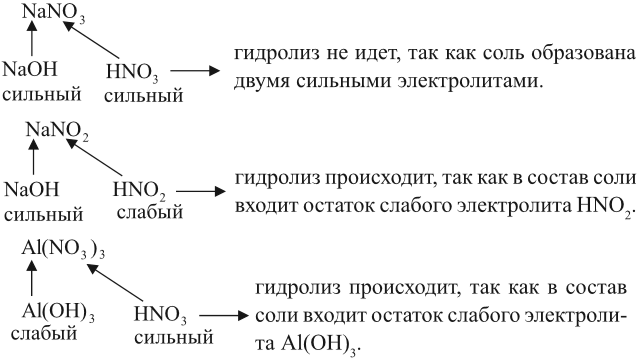
Вывод. Гидролизу подвергаются соли, содержащие остаток слабого электролита.
Например:
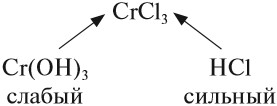
Задание 6.12. Определите, происходит ли гидролиз в растворах хлорида железа (III), силиката натрия, нитрата калия. Ответ поясните.
Алгоритм составления уравнений реакции гидролиза:
1. Определить какие электролиты образуют соль, отметить их силу:
2. Составить уравнение диссоциации соли, подчеркнуть ион, соответствующий слабому электролиту:
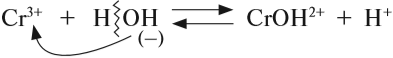
3. Для иона слабого электролита составить уравнение реакции взаимодействия с одной молекулой воды (уравнение гидролиза):
- из молекулы воды притягивается противоположно заряженный нон, в данном случае ОН–;
- сумма зарядов до и после реакции равна:
4. Определить реакцию среды в образовавшемся растворе: в данном случае образовались ионы Н+, значит, среда кислая, рН< 7.
Вопрос. Какую окраску будет иметь лакмус в этом растворе?
5. Для того чтобы составить молекулярное уравнение реакции гидролиза, следует:
- дописать к каждому иону ионы, которые образуются при диссоциации, с противоположным зарядом (в данном случае ионы Cl–);
- составить полученные формулы по валентности (валентность = заряду иона!):
Задание 6.13. Составить уравнения реакций гидролиза для: сульфата алюминия; силиката калия; хлорида натрия; нитрата меди (II); сульфида калия.
Задание 6.14. Как при помощи лакмуса различить бесцветные растворы солей: нитрата свинца (II), сульфата калия, сульфида натрия?

Выводы
Растворы — это однородная смесь двух или более компонентов. При образовании растворов в результате сольватации происходит дробление растворяемого вещества до молекул или ионов.
Истинный раствор — это однородная смесь молекул и ионов различных веществ.
Электролиты это вещества, которые в водных растворах распадаются на ионы (диссоциируют). Уравнения реакций для таких веществ составляют с учётом этого процесса в ионно-молекулярной форме. Реакции ионного обмена, в том числе гидролиз, осуществимы, если происходит связывание ионов, т. е. образуется осадок, газ или слабый электролит.