Урок 4. Взаимодействие молекул
В уроке 4 «Взаимодействие молекул» из курса «Химия для чайников» выясним что из себя представляет межмолекулярное взаимодействие; рассмотрим влияние сил Ван-дер-Ваальса на температуры плавления и кипения; определим роль электроотрицательности в образовании ковалентной полярной и водородной связи. Но нельзя обсуждать взаимодействие молекул, не зная их строения, поэтому не пройдите мимо прошлого урока «Схема образования молекул».
Содержание
Межмолекулярное взаимодействие
Между молекулами в веществе всегда присутствует некоторое притяжение друг к другу, которое называется межмолекулярным взаимодействием. Притяжение молекул друг к другу не такое сильное, как взаимодействие между атомами в молекуле, и недостаточно для образования химических связей, но достаточно для того, чтобы сделать их слегка «клейкими» друг к другу.
Силы Ван-дер-Ваальса
Силы взаимодействия молекул, вызываемые мгновенными флюктуациями распределения электронов в атомах, называются силами Ван-дер-Ваальса. Заумно прозвучало? Далее все встанет на свои места. Силы Ван-дер-Ваальса являются одним из видов межмолекулярного взаимодействия, но можно считать эти силы взаимодействия молекул основными. Просто запомните, что именно благодаря силам Ван-дер-Ваальса в природе существуют три агрегатных состояния вещества.
Температура плавления и кипения
Возможно вы уже слышали, что температура представляет собой меру энергии теплового движения молекул, т.е. скорость движения и колебаний молекул (и атомов) зависит от температуры. При низких температурах энергия теплового движения молекул очень мала, поэтому молекулы как бы «сонные» и Ван-дер-Ваальсовы силы без труда удерживают их вместе в упорядоченной плотноупакованной кристаллической решетке. Очевидно, что эта ситуация описывает твердое кристаллическое состояние. Если к телу в твердом кристаллическом состоянии подводится тепло, то молекулы «просыпаются» и начинают все сильнее колебаться относительно своих равновесных положений в кристаллической решетке. В том случае, если к кристаллу подведено достаточное количество энергии, молекулы начинают «бодрствовать»: они разрушают кристаллическую решетку и начинают свободно скользить одна вдоль другой, но пока еще соприкасаются друг с другом. Эта ситуация иллюстрирует жидкое состояние, а температура перехода из твердого состояние в жидкое называется температурой плавления вещества. Но молекулы жидкости по-прежнему удерживается силами Ван-дер-Ваальса, хотя уже имеют достаточную энергию, чтобы не оставаться в фиксированном положении. Если к жидкости подводится дополнительная энергия, молекулы превращаются в суперменов и начинают двигаться очень быстро и даже способны преодолевать Ван-дер-Ваальсовы силы притяжения, полностью отдаляясь одна от другой. Это соответствует переходу жидкости в газовую фазу. Молекулы в газе двигаются хаотично (по независимым молекулярным траекториям). Температура кипения вещества – это температура, которая необходима для полного преодоления сил Ван-дер-Ваальса в жидкости.
В таблице, которая расположена ниже, сопоставлены температуры плавления и кипения некоторых веществ, состоящих из простых молекул. Как правило, большим по размеру молекулам соответствуют более высокие температуры плавления и кипения, потому что такие молекулы обладают бОльшей поверхностью, что приводит к большим силам Ван-дер-Ваальса. Вот почему при одном и том же давлении H2 кипит при -252°С, а CH4 при -164°C, а C8H18 следует нагреть до +125,7°C, чтобы его молекулы отделились одна от другой и перешли в газовую фазу.
Ковалентная полярная химическая связь
Помимо Ван-дер-Ваальсовых сил есть и другие силы межмолекулярного взаимодействия, связанные с типом химической связи, а именно с полярностью молекул. Если два атома связаны друг с другом ковалентной связью, но один из них притягивает к себе электронную пару сильнее, чем другой атом, то электронная пара смещается в сторону более «сильного» атома. На «сильном» атоме возникает некоторый избыток отрицательного заряда, записываемый символом δ— (а не знаком минус, так как это означало бы полный электронный заряд), а на другом появляется небольшой положительный заряд δ+, и подобно разноименным зарядам они начинают притягиваться друг к другу, образуя ковалентную полярную химическую связь.
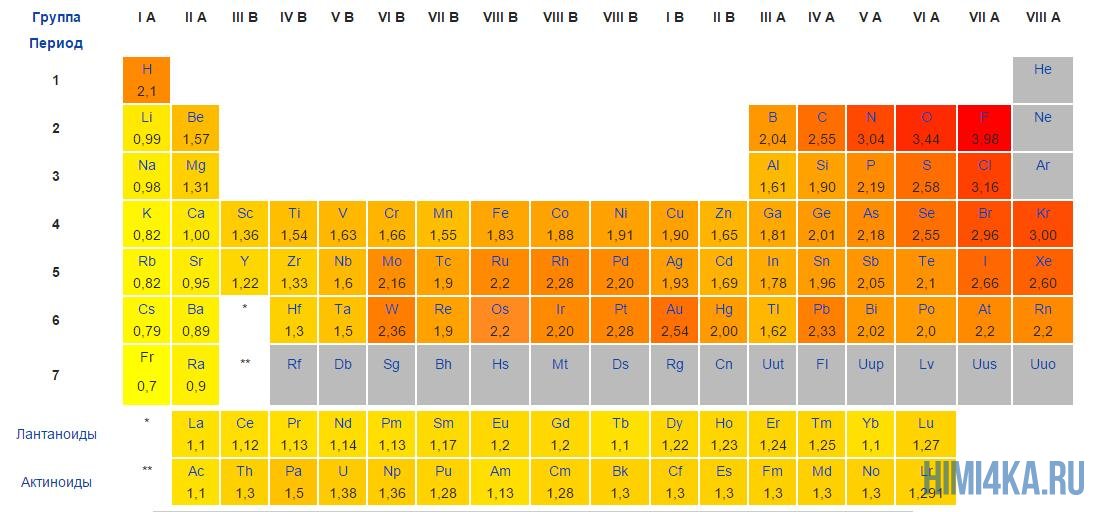
«Силу» атома определяет его электроотрицательность: чем больше электроотрицательность химического элемента, тем сильнее он притягивает к себе электроны.
Приведем примеры молекул, образованных ковалентной полярной связью: CO, H2O, HCl. Из примеров видно что, ковалентная полярная химическая связь, как и неполярная, возникает только между атомами неметаллов и разница в электроотрицательности между ними должна быть более 0.4, но менее 2.0. Если разница в электроотрицательности атомов менее 0.4, то связь между ними считается ковалентной неполярной. Думаю, что теперь у вас сложилось некоторое представление о различиях ковалентной полярной и ковалентной неполярной химической связи.
Постарайтесь запомнить самые электроотрицательные химические элементы в порядке возрастания их электроотрицательности: I, Br, N, Cl, O, F. За помощью вы всегда можете обратиться к таблице электроотрицательности, которая расположена ниже.
Образование водородной связи
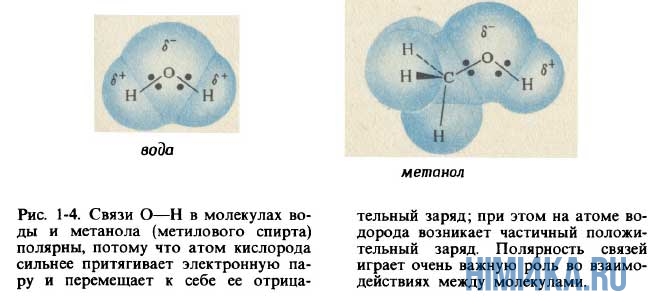
Очевидно, что молекулы воды образованы ковалентной полярной химической связью, поскольку электроотрицательность кислорода больше, чем у водорода. Поэтому атом кислорода в молекуле воды несет в себе небольшой отрицательный заряд, а атомы водорода — небольшие положительные заряды.
Подобные молекулы называются полярными, поскольку они ведут себя как крошечные электрические диполи; другими словами, отрицательный заряд на атоме кислорода притягивает расположенные поблизости положительные заряды, а положительно заряженные атомы водорода притягивают другие отрицательные заряды. Так возникает еще один тип сил притяжения между молекулами, помимо вандерваальсовых сил притяжения. Вследствие наличия дополнительных сил взаимодействия между полярными молекулами метанола CH3OH (метилового спирта) он плавится и кипит при гораздо более высоких температурах, чем метан CH4, который имеет сходные с метанолом размеры молекул. При комнатной температуре метанол представляет собой жидкость, а метан — газ. В воде силы притяжения между атомами водорода и кислорода, принадлежащими различным молекулам, столь велики, что получили название водородных связей. Водородные связи играют чрезвычайно важную роль в белках и других гигантских молекулах, из которых построены живые организмы. Если бы не полярность молекул воды и наличие между ними водородных связей, вода плавилась бы и кипела при более низких температурах, чем даже сероводород (см. табл. в начале урока). При комнатной температуре она находилась бы в газообразном состоянии, а не в виде наиболее распространенной на Земле жидкости.
Надеюсь урок 4 «Взаимодействие молекул» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.